题目
硫酸在化工生产国民经济发展中占有极其重要的地位,如图是工业接触法制硫酸的简单流程图。试回答下列有关问题:②-|||-经净化 催化剂-|||-n-|||-热交换器 B-|||-黄铁矿 A-|||-矿渣 催化剂-|||-__ ①-|||-空气 c-|||-沸腾炉 接触室 吸收塔(1)写出工业上用FeS2制取SO2的化学方程式 ____ ;(2)在硫酸工业生产过程中,需要考虑的因素很多,主要有生产原料的选择与净化反应条件和设备的选择、 ____ ;(3)反应2SO2+O2⇌2SO3是在400~500℃条件下在接触室中进行的,选择这一反应条件的理由是在 ____ ,在实际生产过程中进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是 ____ ;(4)硫酸工厂形成的“三废”对环境有较大的影响,处理硫酸工厂尾气的化学方程式是 ____ ;(5)下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫;②-|||-经净化 催化剂-|||-n-|||-热交换器 B-|||-黄铁矿 A-|||-矿渣 催化剂-|||-__ ①-|||-空气 c-|||-沸腾炉 接触室 吸收塔①若丁装置在反应过程中出现气泡,不久就出现了自雾,而丙装置一直没有明显变化,丁装置产生白雾的原因是 ____ ,此现象对工业上制硫酸带来的不良后果是 ____ ;②上图中的乙装置和丙装置分别与工业制取硫酸的某个装置相对应,其中乙装置对应的是接触室; 丙装置对应的是 ____ 。
硫酸在化工生产国民经济发展中占有极其重要的地位,如图是工业接触法制硫酸的简单流程图。
试回答下列有关问题:
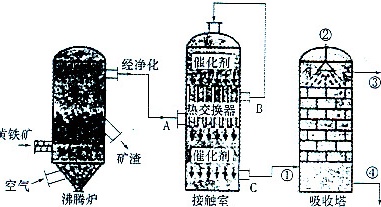
(1)写出工业上用FeS2制取SO2的化学方程式 ____ ;
(2)在硫酸工业生产过程中,需要考虑的因素很多,主要有生产原料的选择与净化反应条件和设备的选择、 ____ ;
(3)反应2SO2+O2⇌2SO3是在400~500℃条件下在接触室中进行的,选择这一反应条件的理由是在 ____ ,在实际生产过程中进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是 ____ ;
(4)硫酸工厂形成的“三废”对环境有较大的影响,处理硫酸工厂尾气的化学方程式是 ____ ;
(5)下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫;
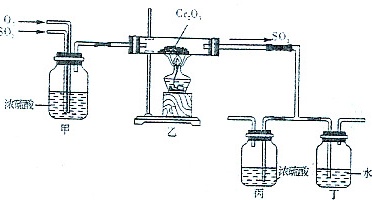
①若丁装置在反应过程中出现气泡,不久就出现了自雾,而丙装置一直没有明显变化,丁装置产生白雾的原因是 ____ ,此现象对工业上制硫酸带来的不良后果是 ____ ;
②上图中的乙装置和丙装置分别与工业制取硫酸的某个装置相对应,其中乙装置对应的是接触室; 丙装置对应的是 ____ 。
试回答下列有关问题:

(1)写出工业上用FeS2制取SO2的化学方程式 ____ ;
(2)在硫酸工业生产过程中,需要考虑的因素很多,主要有生产原料的选择与净化反应条件和设备的选择、 ____ ;
(3)反应2SO2+O2⇌2SO3是在400~500℃条件下在接触室中进行的,选择这一反应条件的理由是在 ____ ,在实际生产过程中进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是 ____ ;
(4)硫酸工厂形成的“三废”对环境有较大的影响,处理硫酸工厂尾气的化学方程式是 ____ ;
(5)下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫;

①若丁装置在反应过程中出现气泡,不久就出现了自雾,而丙装置一直没有明显变化,丁装置产生白雾的原因是 ____ ,此现象对工业上制硫酸带来的不良后果是 ____ ;
②上图中的乙装置和丙装置分别与工业制取硫酸的某个装置相对应,其中乙装置对应的是接触室; 丙装置对应的是 ____ 。
题目解答
答案
解:(1)FeS2燃烧生成Fe2O3和SO2,故化学方程式4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(2)在硫酸工业生产过程中,需要考虑的因素很多,主要有生产原料的选择与净化反应条件和设备的选择、废热(工业三废的利用),
故答案为:废热(工业三废的利用);
(3)反应2SO2+O2⇌2SO3是在400~500℃条件下在接触室中进行的,选择这一反应条件的理由是在该温度下催化剂的活性较高,同时反应速率较大,且转化率较高;在实际生产过程中进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是为了提高二氧化硫的转化率,
故答案为:该温度下催化剂的活性较高,同时反应速率较大,且转化率较高;为了提高二氧化硫的转化率;
(4)硫酸工厂用氨水处理尾气,氨水和SO2反应,其化学方程式为:SO2+2NH3•H2O=(NH4)2SO3+H2O,SO2+NH3•H2O=NH4HSO3,
故答案为:SO2+2NH3•H2O=(NH4)2SO3+H2O,SO2+NH3•H2O=NH4HSO3;
(5)①若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,故丁装置产生白雾的原因是可能是丙中插入浓硫酸溶液的导管插得较深,使两个吸收瓶内的压强差较大,而导致SO3从丁的水中冒了出来,与水形成酸雾;此现象对工业上制硫酸带来的不良后果是酸雾阻碍三氧化硫的吸收,
故答案为:可能是丙中插入浓硫酸溶液的导管插得较深,使两个吸收瓶内的压强差较大,而导致SO3从丁的水中冒了出来,与水形成酸雾;酸雾阻碍三氧化硫的吸收;
②装置乙为二氧化硫的催化氧化,对应工业中接触室,丙装置吸收三氧化硫,对应工业中吸收塔,
故答案为:吸收塔。
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
(2)在硫酸工业生产过程中,需要考虑的因素很多,主要有生产原料的选择与净化反应条件和设备的选择、废热(工业三废的利用),
故答案为:废热(工业三废的利用);
(3)反应2SO2+O2⇌2SO3是在400~500℃条件下在接触室中进行的,选择这一反应条件的理由是在该温度下催化剂的活性较高,同时反应速率较大,且转化率较高;在实际生产过程中进入接触室的气体中O2的体积分数是SO2体积分数的1.5倍,其原因是为了提高二氧化硫的转化率,
故答案为:该温度下催化剂的活性较高,同时反应速率较大,且转化率较高;为了提高二氧化硫的转化率;
(4)硫酸工厂用氨水处理尾气,氨水和SO2反应,其化学方程式为:SO2+2NH3•H2O=(NH4)2SO3+H2O,SO2+NH3•H2O=NH4HSO3,
故答案为:SO2+2NH3•H2O=(NH4)2SO3+H2O,SO2+NH3•H2O=NH4HSO3;
(5)①若丁装置在反应过程中出现气泡,不久就出现了白雾,而丙装置一直没有明显变化,故丁装置产生白雾的原因是可能是丙中插入浓硫酸溶液的导管插得较深,使两个吸收瓶内的压强差较大,而导致SO3从丁的水中冒了出来,与水形成酸雾;此现象对工业上制硫酸带来的不良后果是酸雾阻碍三氧化硫的吸收,
故答案为:可能是丙中插入浓硫酸溶液的导管插得较深,使两个吸收瓶内的压强差较大,而导致SO3从丁的水中冒了出来,与水形成酸雾;酸雾阻碍三氧化硫的吸收;
②装置乙为二氧化硫的催化氧化,对应工业中接触室,丙装置吸收三氧化硫,对应工业中吸收塔,
故答案为:吸收塔。