习题:第一章 第二章 第三章 第四章 第五章 第六章 第七章 第八章 第九章 第十章 第十一章 答案:第一章 第二章 第三章 第四章 第五章 第六章 第七章 第八章 第九章 第十章 第十一章 3-2 略。 3-2试述位错的基本类型及其特点。 解:位错主要有两种:刃型位错和螺型位错。刃型位错特点:滑移方向与位错线垂直,符号⊥,有多余半片原子面。螺型位错特点:滑移方向与位错线平行,与位错线垂直的面不是平面,呈螺施状,称螺型位错。 3-3非化学计量化合物有何特点?为什么非化学计量化合物都是n型或p型半导体材料? 解:非化学计量化合物的特点:非化学计量化合物产生及缺陷浓度与气氛性质、压力有关;可以看作是高价化合物与低价化合物的固溶体;缺陷浓度与温度有关,这点可以从平衡常数看出;非化学计量化合物都是半导体。由于负离子缺位和间隙正离子使金属离子过剩产生金属离子过剩(n型)半导体,正离子缺位和间隙负离子使负离子过剩产生负离子过剩(p型)半导体。 3-4影响置换型固溶体和间隙型固溶体形成的因素有哪些? 解:影响形成置换型固溶体影响因素: (1.离子尺寸:15%规律:1.(R-R)/R1>15%不连续。2.<15%连续。3.>40%不能形成固熔体。(2)离子价:电价相同,形成连续固熔体。 ( 3)晶体结构因素:基质,杂质结构相同,形成连续固熔体。(4)场强因素。(5)电负性:差值小,形成固熔体。差值大形成化合物。 影响形成间隙型固溶体影响因素:(1)杂质质点大小:即添加的原子愈小,易形成固溶体,反之亦然。(2)晶体(基质)结构:离子尺寸是与晶体结构的关系密切相关的,在一定程度上来说,结构中间隙的大小起了决定性的作用。一般晶体中空隙愈大,结构愈疏松,易形成固溶体。(3)电价因素:外来杂质原子进人间隙时,必然引起晶体结构中电价的不平衡,这时可以通过生成空位,产生部分取代或离子的价态变化来保持电价平衡。 3-5试分析形成固溶体后对晶体性质的影响。 解:影响有:(1)稳定晶格,阻止某些晶型转变的发生;(2)活化晶格,形成固溶体后,晶格结构有一定畸变,处于高能量的活化状态,有利于进行化学反应;(3)固溶强化,溶质原子的溶入,使固溶体的强度、 硬度升高;(4)形成固溶体后对材料物理性质的影响:固溶体的电学、热学、磁学等物理性质也随成分而连续变化,但一般都不是线性关系。固溶体的强度与硬度往往高于各组元,而塑性则较低,3-6说明下列符号的含义:V,V',V˙,(V'V˙),Ca˙,Ca,Ca˙˙ 解:钠原子空位;钠离子空位,带一个单位负电荷;氯离子空位,带一个单位正电荷;最邻近的NaNa空位、ClNa空位形成的缔合中心;CaCl占据K.位置,带一个单位正电荷;Ca原子位于Ca原子位置上;CaNa处于晶格间隙位置。 3-7写出下列缺陷反应式:(l)NaCl溶入CaCl+中形成空位型固溶体;(2)CaCl-溶入NaCl中形成空位型固溶体;(3)NaCl形成肖特基缺陷;(4)Agl形成弗伦克尔缺陷(Ag2+进入间隙)。 解: (1)NaClNa2’+ Cl2 + V+ (2)CaClCaNa + 2Cl + V’ (3)OV’ + V (4)AgAgV’ + Ag 3.8 MgO的密度是3.58g/cmCa,其晶格参数是0.42nm,计算单位晶胞MgO的肖特基缺陷数。 解:设有缺陷的MgO晶胞的晶胞分子数为x,晶胞体积V=(4.20.3.x=ρVN0/M=3.96,单位晶胞的肖脱基缺陷数=4-x=0.04。 3-9 MgO(NaCl型结构)和Li3O(反萤石型结构)均以氧的立方密堆为基础,而且阳离子都在这种排列的间隙中,但在MgO中主要的点缺陷是肖特基缺陷,而在LiO中是弗伦克尔型,请解释原因。 解:Mg占据四面体空隙,Li占据八面体空隙。 3.10 MgO晶体的肖特基缺陷生成能为84kJ/mol,计算该晶体1000K和1500K的缺陷浓度。(答:6.4×10,3.5×10) 解:n/N=exp(-E/2RT),R=8.3.4,T=1000k:n/N=6.4×10-;T=1500k:n/N=3.5×103。 3-11非化学计量化合物 Fe-3O中,Fe-2.Fe=0.1,求 FeO中的空位浓度及 x值。(答: 2.25×10;0.956) 解:FexO3+2Fe2+x + 3O- + V5’’ y 2y yFe23FeFe·O, X=1-y=1-0.0435=0.9565,Fe3+O [V2.’’]===2.22×102+ 3-12非化学计量缺陷的浓度与周围气氛的性质、压力大小相关,如果增大周围氧气的分压.非化学计量化合物Fe0.9565O及ZnFeO的密度将发生怎么样的变化?增大还是减小?为什么? 解: Zn(g)Zni1-x + e’Zn(g) + 1/2O· = ZnO Zni2 + e’+ 1/2O ZnO[ZnO]=[e’]∴PO [Zni] ρ O(g) OO + V’’ + 2h k=[OO][ V’’][h]/PO1/2=4[OO][ V’’]3/ PO1/2 [ V2’’] ∝PO·1/6,∴ POFe [ V2-’’] ρ 3-13对于刃位错和螺位错,区别其位错线方向、伯氏矢量和位错运动方向的特点。 解:刃位错:位错线垂直于位错线垂直于位错运动方向;螺位错:位错线平行于 位错线平行于位错运动方向。 3-14图3-1是晶体二维图形,内含有一个正刃位错和一个负刃位错。 (1)围绕两个位错伯格斯回路,最后得伯格斯矢量若干? (2)围绕每个位错分别作伯氏回路,其结果又怎样? 图3-1 解:略。 3-15有两个相同符号的刃位错,在同一滑移面上相遇,它们将是排斥还是吸引? 解:排斥,张应力重叠,压应力重叠。 3-16晶界对位错的运动将发生怎么样的影响?能预计吗? 解:晶界对位错运动起阻碍作用。 3-17晶界有小角度晶界与大角度晶界之分,大角度晶界能用位错的阵列来描述吗? 解:不能,在大角度晶界中,原子排列接近于无序的状态,而位错之间的距离可能只有1、2个原子的大小,不适用于大角度晶界。 3-18从化学组成、相组成考虑,试比较固溶体与化合物、机械混合物的差别。align=center> 3-19试阐明固溶体、晶格缺陷和非化学计量化合物三者之间的异同点,列出简明表格比较。 解:固溶体、晶格缺陷、非化学计量化合物都是点缺陷,是晶体结构缺陷,都是单相均匀的固体,结构同主晶相。 热缺陷——本征缺陷;固溶体——非本征缺陷;无:受温度控制 有:搀杂量<固溶度 受温度控制 搀杂量>固溶度 受固溶度控制 3-20在面心立方空间点阵中,面心位置的原子数比立方体项角位置的原子数多三倍。原子B溶入A晶格的面心位置中,形成置换型固溶体,其成分应该是AB呢还是AB?为什么?
1.离子尺寸:15%规律:1.(R-R)/R1>15%不连续。
2.<15%连续。
3.>40%不能形成固熔体。(2)离子价:电价相同,形成连续固熔体。 ( 3)晶体结构因素:基质,杂质结构相同,形成连续固熔体。(4)场强因素。(5)电负性:差值小,形成固熔体。差值大形成化合物。 影响形成间隙型固溶体影响因素:(1)杂质质点大小:即添加的原子愈小,易形成固溶体,反之亦然。(2)晶体(基质)结构:离子尺寸是与晶体结构的关系密切相关的,在一定程度上来说,结构中间隙的大小起了决定性的作用。一般晶体中空隙愈大,结构愈疏松,易形成固溶体。(3)电价因素:外来杂质原子进人间隙时,必然引起晶体结构中电价的不平衡,这时可以通过生成空位,产生部分取代或离子的价态变化来保持电价平衡。 3-5试分析形成固溶体后对晶体性质的影响。 解:影响有:(1)稳定晶格,阻止某些晶型转变的发生;(2)活化晶格,形成固溶体后,晶格结构有一定畸变,处于高能量的活化状态,有利于进行化学反应;(3)固溶强化,溶质原子的溶入,使固溶体的强度、 硬度升高;(4)形成固溶体后对材料物理性质的影响:固溶体的电学、热学、磁学等物理性质也随成分而连续变化,但一般都不是线性关系。固溶体的强度与硬度往往高于各组元,而塑性则较低,3-6说明下列符号的含义:V,V',V˙,(V'V˙),Ca˙,Ca,Ca˙˙ 解:钠原子空位;钠离子空位,带一个单位负电荷;氯离子空位,带一个单位正电荷;最邻近的NaNa空位、ClNa空位形成的缔合中心;CaCl占据
K.位置,带一个单位正电荷;Ca原子位于Ca原子位置上;CaNa处于晶格间隙位置。 3-7写出下列缺陷反应式:(l)NaCl溶入CaCl+中形成空位型固溶体;(2)CaCl-溶入NaCl中形成空位型固溶体;(3)NaCl形成肖特基缺陷;(4)Agl形成弗伦克尔缺陷(Ag2+进入间隙)。 解: (1)NaClNa2’+ Cl2 + V+ (2)CaClCaNa + 2Cl + V’ (3)OV’ + V (4)AgAgV’ + Ag
3.8 MgO的密度是3.58g/cmCa,其晶格参数是
0.42nm,计算单位晶胞MgO的肖特基缺陷数。 解:设有缺陷的MgO晶胞的晶胞分子数为x,晶胞体积V=(
4.2
0.
3.x=ρVN0/M=3.96,单位晶胞的肖脱基缺陷数=4-x=0.04。 3-9 MgO(NaCl型结构)和Li3O(反萤石型结构)均以氧的立方密堆为基础,而且阳离子都在这种排列的间隙中,但在MgO中主要的点缺陷是肖特基缺陷,而在LiO中是弗伦克尔型,请解释原因。 解:Mg占据四面体空隙,Li占据八面体空隙。
3.10 MgO晶体的肖特基缺陷生成能为84kJ/mol,计算该晶体1000K和1500K的缺陷浓度。(答:
6.4×10,3.5×10) 解:n/N=exp(-E/2RT),R=
8.
3.4,T=1000k:n/N=
6.4×10-;T=1500k:n/N=3.5×103。 3-11非化学计量化合物 Fe-3O中,Fe-
2.Fe=
0.1,求 FeO中的空位浓度及 x值。(答: 2.25×10;0.956) 解:FexO3+2Fe2+x + 3O- + V5’’ y 2y yFe23FeFe·O, X=1-y=1-
0.0435=0.9565,Fe3+O [V
2.’’]===2.22×102+ 3-12非化学计量缺陷的浓度与周围气氛的性质、压力大小相关,如果增大周围氧气的分压.非化学计量化合物Fe
0.9565O及ZnFeO的密度将发生怎么样的变化?增大还是减小?为什么? 解: Zn(g)Zni1-x + e’Zn(g) + 1/2O· = ZnO Zni2 + e’+ 1/2O ZnO[ZnO]=[e’]∴PO [Zni] ρ O(g) OO + V’’ + 2h k=[OO][ V’’][h]/PO1/2=4[OO][ V’’]3/ PO1/2 [ V2’’] ∝PO·1/6,∴ POFe [ V2-’’] ρ 3-13对于刃位错和螺位错,区别其位错线方向、伯氏矢量和位错运动方向的特点。 解:刃位错:位错线垂直于位错线垂直于位错运动方向;螺位错:位错线平行于 位错线平行于位错运动方向。 3-14图3-1是晶体二维图形,内含有一个正刃位错和一个负刃位错。 (1)围绕两个位错伯格斯回路,最后得伯格斯矢量若干? (2)围绕每个位错分别作伯氏回路,其结果又怎样? 图3-1 解:略。 3-15有两个相同符号的刃位错,在同一滑移面上相遇,它们将是排斥还是吸引? 解:排斥,张应力重叠,压应力重叠。 3-16晶界对位错的运动将发生怎么样的影响?能预计吗? 解:晶界对位错运动起阻碍作用。 3-17晶界有小角度晶界与大角度晶界之分,大角度晶界能用位错的阵列来描述吗? 解:不能,在大角度晶界中,原子排列接近于无序的状态,而位错之间的距离可能只有1、2个原子的大小,不适用于大角度晶界。 3-18从化学组成、相组成考虑,试比较固溶体与化合物、机械混合物的差别。align=center> 3-19试阐明固溶体、晶格缺陷和非化学计量化合物三者之间的异同点,列出简明表格比较。 解:固溶体、晶格缺陷、非化学计量化合物都是点缺陷,是晶体结构缺陷,都是单相均匀的固体,结构同主晶相。 热缺陷——本征缺陷;固溶体——非本征缺陷;无:受温度控制 有:搀杂量<固溶度 受温度控制 搀杂量>固溶度 受固溶度控制 3-20在面心立方空间点阵中,面心位置的原子数比立方体项角位置的原子数多三倍。原子B溶入A晶格的面心位置中,形成置换型固溶体,其成分应该是AB呢还是AB?为什么?
题目解答
答案
解:略。
3-21 Al2O3在 MgO中形成有限固溶体,在低共熔温度 1995℃时.约有18wt%Al2O3溶入 MgO中,假设MgO单位晶胞尺寸变化可忽略不计。试预计下列情况的密度变化。1)Al3+为填隙离子;2)Al3+为置换离子。
解: (a)Al3+为填隙离子:
缺陷反应为: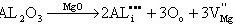 (1)
(1)
固溶式分子式: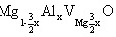
(b)Al3+为置换离子:
缺陷反应为: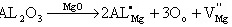 (2)
(2)
固溶式分子式: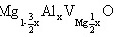 (3)
(3)
取100g试样为基准:(为摩尔数)
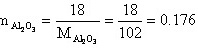 (m为摩尔数)
(m为摩尔数)
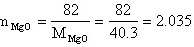
∴MgO中固溶18%wt的Al2O3后的分子式为:
2.035 MgO·0.176 Al2O3或Mg2.035Al0.352O2.563 (4)
(4)式各项除以2.563得Mg0.794Al0.137O (5)
由(5)式得x=0.137代入(2)(3)式,
对(a)有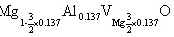
即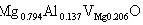
(b)有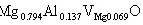
设:固溶前后晶胞体积不变,则密度变化为: 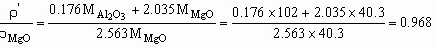
(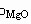 ,
,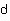 分别代表固溶前后密度)
分别代表固溶前后密度)
所以,固溶后的密度小于固溶前的密度。
3-22对硫铁矿进行化学分析:按分析数据的Fe/S计算,得出两种可能的成分:Fe1-xS和FeS1-x,前者意味着是Fe空位的缺陷结构,后者是Fe被置换。设想用一种实验方法以确定该矿物究竟属哪一类成分?
解:Fe1-xS中存在Fe空位,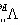 非化学计量,存在h· P型半导体;FeS1-x中金属离子过剩,存在S2-空位,存在
非化学计量,存在h· P型半导体;FeS1-x中金属离子过剩,存在S2-空位,存在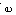 N型半导体;因Fe1-xS、FeS1-x分属不同类型半导体,通过实验确定其半导体性质即可。
N型半导体;因Fe1-xS、FeS1-x分属不同类型半导体,通过实验确定其半导体性质即可。
3-23说明为什么只有置换型固溶体的两个组分之间才能相互完全溶解,而填隙型固溶体则不能。
解:(1)晶体中间隙位置是有限的,容纳杂质质点能力<10%;(2)间隙式固溶体的生成,一般都使晶格常数增大,增加到一定的程度,使晶格变得不稳定而离解;置换固溶体形成是同号离子交换位置,不会对接产生影响,所以可形成连续固溶体。
3-24对于 MgO、Al2O3和 Cr2O3,其正、负离子半径比分别为 0.47、0.36和 0.40,则 Al2O3和Al2O3形成连续固溶体。(1)这个结果可能吗?为什么?(2)试预计,在MgO-Cr2O3系统中的固溶度是有限的还是无限的?为什么?
解:(1)Al2O3与Cr2O3能形成连续固溶体,
原因:1)结构内型相同,同属于刚玉结构。
2)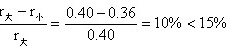
(2)MgO与Cr2O3的固溶度为有限
原因:结构类型不同MgO属于NaCl型结构,Cr2O3属刚玉结构。
虽然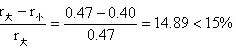
也不可能形成连续固溶体。
3-25某种NiO是非化学计量的,如果NiO中Ni3+/Ni2+=10-4,问每1m3中有多少载流子?
解:设非化学计量化合物为NixO, Ni2O3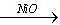 2
2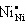 + 3
+ 3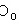 +
+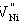 y 2y y
y 2y y
Ni3+2yNi2+1-3yO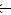 Ni3+/Ni2+=2y/(1-3y)=10-x 则y=5×10-5, x=1-y=0.99995,
Ni3+/Ni2+=2y/(1-3y)=10-x 则y=5×10-5, x=1-y=0.99995,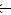 Ni0.99995O 每m3中有多少载流子即为空位浓度:[
Ni0.99995O 每m3中有多少载流子即为空位浓度:[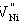 ]=y/(1+x)=2.5×10-5。
]=y/(1+x)=2.5×10-5。
3-26在 MgO-Al2O3和 PbTiO3-PbZrO3中哪一对形成有限固溶体,哪一对形成无限固溶体,为什么?
解:MgO-AL2O3: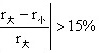 ,即rMg、rAl半径相差大,MgO(NaCl型)、AL2O3(刚玉)结构类型差别大,形成有限固溶体; PbTiO3-PbZrO3形成无限固溶体,因为尽管Ti4+、Zr4+半径相差较大(15. 28),但都是(ABO3)钙钛矿型结构,Ti4+、Zr4+都填充八面体空隙,该空隙体积较大,可填入的阳离子的半径r值可在一定范围内变化,而不至于使结构变化。
,即rMg、rAl半径相差大,MgO(NaCl型)、AL2O3(刚玉)结构类型差别大,形成有限固溶体; PbTiO3-PbZrO3形成无限固溶体,因为尽管Ti4+、Zr4+半径相差较大(15. 28),但都是(ABO3)钙钛矿型结构,Ti4+、Zr4+都填充八面体空隙,该空隙体积较大,可填入的阳离子的半径r值可在一定范围内变化,而不至于使结构变化。
3-27 CeO2 为萤石结构,其中加入15mol%CaO形成固溶体,测得固溶体密度d=7.01g/cm3,晶胞参数a=0.5417nm,试通过计算判断生成的是哪一种类型固溶体。已知原子量Ce 140.12,Ca 40.08,O 16.00。
解:对于CaO-CeO2固溶体来说,从满足电中性来看,可以形成氧离子空位的固溶体也可形成Ca2+嵌入阴离子间隙中的固溶体,其固溶方程为:
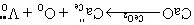
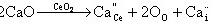 对于置换式固溶体有 x=0.15,1-x=0.85,2-x=1.85,所以置换式固溶体化学式Ca0.15Ce0.85O1.85。有因为CeO2属于萤石结构,晶胞分子数Z=4,晶胞中有Ca2+、Ce4+、O2-三种质点。 晶胞质量
对于置换式固溶体有 x=0.15,1-x=0.85,2-x=1.85,所以置换式固溶体化学式Ca0.15Ce0.85O1.85。有因为CeO2属于萤石结构,晶胞分子数Z=4,晶胞中有Ca2+、Ce4+、O2-三种质点。 晶胞质量
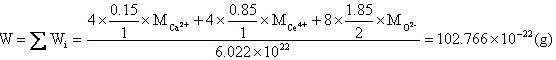
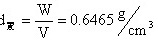
对于间隙固溶体,其化学式Ca2yCe1-yO2,与已知组成Ca0.15Ce0.85O1.85相比,O2-不同, Ca0.15Ce0.85O1.85 Ca0.15×2/1.85Ce0.83×2/1.85O2
Ca0.15×2/1.85Ce0.83×2/1.85O2