题目
硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如图:菱锌矿 H2SO4-|||-x KMnO4 Zn粉 HF-|||-焙烧 浸取 阅 =5 虑液① 氧化 虑液② 转化 滤液③ 脱钙镁 虑液④ ZnSO4·7H2O-|||-过滤 过滤 过滤 过滤-|||-滤渣① 滤渣② 滤渣③ 滤渣④本题中所涉及离子的氢氧化物溶度积常数如下表: 离子 Fe3+ Zn2+ Cu2+ Fe2+ Mg2+ Ksp 4.0×10-38 6.7×10-17 2.2×10-20 8.0×10-16 1.8×10-11 回答下列问题:(1)菱锌矿焙烧生成氧化锌的化学方程式为 ____ 。(2)为了提高锌的浸取效果,可采取的措施有 ____ 、 ____ 。(3)加入物质X调溶液pH=5,最适宜使用的X是 ____ (填标号)。A.NH3•H2OB.Ca(OH)2C.NaOH滤渣①的主要成分是 ____ 、 ____ 、 ____ 。(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为 ____ 。(5)滤液②中加入锌粉的目的是 ____ 。(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是 ____ 、 ____ 。
硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如图:
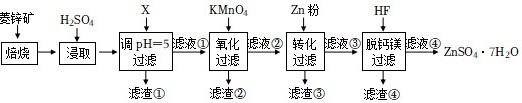
本题中所涉及离子的氢氧化物溶度积常数如下表:
回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为 ____ 。
(2)为了提高锌的浸取效果,可采取的措施有 ____ 、 ____ 。
(3)加入物质X调溶液pH=5,最适宜使用的X是 ____ (填标号)。
A.NH3•H2O
B.Ca(OH)2
C.NaOH
滤渣①的主要成分是 ____ 、 ____ 、 ____ 。
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为 ____ 。
(5)滤液②中加入锌粉的目的是 ____ 。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是 ____ 、 ____ 。

本题中所涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Fe3+ | Zn2+ | Cu2+ | Fe2+ | Mg2+ |
| Ksp | 4.0×10-38 | 6.7×10-17 | 2.2×10-20 | 8.0×10-16 | 1.8×10-11 |
(1)菱锌矿焙烧生成氧化锌的化学方程式为 ____ 。
(2)为了提高锌的浸取效果,可采取的措施有 ____ 、 ____ 。
(3)加入物质X调溶液pH=5,最适宜使用的X是 ____ (填标号)。
A.NH3•H2O
B.Ca(OH)2
C.NaOH
滤渣①的主要成分是 ____ 、 ____ 、 ____ 。
(4)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为 ____ 。
(5)滤液②中加入锌粉的目的是 ____ 。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是 ____ 、 ____ 。
题目解答
答案
解:(1)由分析,焙烧时,生成ZnO的反应为:ZnCO3$\frac{\underline{\;焙烧\;}}$ ZnO+CO2↑,
故答案为:ZnCO3$\frac{\underline{\;焙烧\;}}$ ZnO+CO2↑;
(2)可采用将焙烧后的产物碾碎,增大接触面积、增大硫酸的浓度等方式提高锌的浸取率,
故答案为:将焙烧后的产物碾碎;增大硫酸的浓度;
(3)A.NH3•H2O易分解产生NH3污染空气,且经济成本较高,故A错误;
B.Ca(OH)2不会引入新的杂质,且成本较低,故B正确;
C.NaOH会引入杂质Na+,且成本较高,故C错误;
当沉淀完全时(离子浓度小于10-5mol/L),结合表格Ksp计算各离子完全沉淀时pH<5的只有Fe3+,故滤渣①中有Fe(OH)3,又CaSO4是微溶物,SiO2不溶于酸,故滤渣①的主要成分是Fe(OH)3、CaSO4、SiO2,
故答案为:B;Fe(OH)3;CaSO4;SiO2;
(4)向80~90℃滤液①中加入KMnO4溶液,可氧化Fe2+,得到Fe(OH)3和MnO2的滤渣②,反应的离子方程式为3Fe2++${MnO}_{4}^{-}$+7H2O=3Fe(OH)3↓+MnO2↓+5H+,
故答案为:3Fe2++${MnO}_{4}^{-}$+7H2O=3Fe(OH)3↓+MnO2↓+5H+;
(5)滤液②中加入锌粉,发生反应Zn+Cu2+=Zn2+=Cu,故加入锌粉的目的为置换Cu2+为Cu从而除去,
故答案为:置换Cu2+为Cu从而除去;
(6)由分析,滤渣④为CaF2、MgF2,与浓硫酸反应可得到HF,同时得到的副产物为CaSO4、MgSO4,
故答案为:CaSO4、MgSO4。
故答案为:ZnCO3$\frac{\underline{\;焙烧\;}}$ ZnO+CO2↑;
(2)可采用将焙烧后的产物碾碎,增大接触面积、增大硫酸的浓度等方式提高锌的浸取率,
故答案为:将焙烧后的产物碾碎;增大硫酸的浓度;
(3)A.NH3•H2O易分解产生NH3污染空气,且经济成本较高,故A错误;
B.Ca(OH)2不会引入新的杂质,且成本较低,故B正确;
C.NaOH会引入杂质Na+,且成本较高,故C错误;
当沉淀完全时(离子浓度小于10-5mol/L),结合表格Ksp计算各离子完全沉淀时pH<5的只有Fe3+,故滤渣①中有Fe(OH)3,又CaSO4是微溶物,SiO2不溶于酸,故滤渣①的主要成分是Fe(OH)3、CaSO4、SiO2,
故答案为:B;Fe(OH)3;CaSO4;SiO2;
(4)向80~90℃滤液①中加入KMnO4溶液,可氧化Fe2+,得到Fe(OH)3和MnO2的滤渣②,反应的离子方程式为3Fe2++${MnO}_{4}^{-}$+7H2O=3Fe(OH)3↓+MnO2↓+5H+,
故答案为:3Fe2++${MnO}_{4}^{-}$+7H2O=3Fe(OH)3↓+MnO2↓+5H+;
(5)滤液②中加入锌粉,发生反应Zn+Cu2+=Zn2+=Cu,故加入锌粉的目的为置换Cu2+为Cu从而除去,
故答案为:置换Cu2+为Cu从而除去;
(6)由分析,滤渣④为CaF2、MgF2,与浓硫酸反应可得到HF,同时得到的副产物为CaSO4、MgSO4,
故答案为:CaSO4、MgSO4。
解析
步骤 1:菱锌矿焙烧生成氧化锌的化学方程式
菱锌矿的主要成分为ZnCO_3,焙烧时,ZnCO_3分解生成ZnO和CO_2。
步骤 2:提高锌的浸取效果的措施
为了提高锌的浸取效果,可以采取将焙烧后的产物碾碎,增大接触面积,以及增大硫酸的浓度等方式。
步骤 3:选择最适宜使用的X
A. NH_3•H_2O易分解产生NH_3污染空气,且经济成本较高,故A错误;
B. Ca(OH)_2不会引入新的杂质,且成本较低,故B正确;
C. NaOH会引入杂质Na^{+},且成本较高,故C错误;
步骤 4:滤渣①的主要成分
当沉淀完全时(离子浓度小于10^{-5}mol/L),结合表格K_sp计算各离子完全沉淀时pH<5的只有Fe^{3+},故滤渣①中有Fe(OH)_3,又CaSO_4是微溶物,SiO_2不溶于酸,故滤渣①的主要成分是Fe(OH)_3、CaSO_4、SiO_2。
步骤 5:向80~90℃滤液①中加入KMnO_4溶液的反应
向80~90℃滤液①中加入KMnO_4溶液,可氧化Fe^{2+},得到Fe(OH)_3和MnO_2的滤渣②,反应的离子方程式为3Fe^{2+}+${MnO}_{4}^{-}$+7H_2O=3Fe(OH)_3↓+MnO_2↓+5H^{+}。
步骤 6:滤液②中加入锌粉的目的
滤液②中加入锌粉,发生反应Zn+Cu^{2+}=Zn^{2+}=Cu,故加入锌粉的目的为置换Cu^{2+}为Cu从而除去。
步骤 7:滤渣④与浓H_2SO_4反应的副产物
由分析,滤渣④为CaF_2、MgF_2,与浓硫酸反应可得到HF,同时得到的副产物为CaSO_4、MgSO_4。
菱锌矿的主要成分为ZnCO_3,焙烧时,ZnCO_3分解生成ZnO和CO_2。
步骤 2:提高锌的浸取效果的措施
为了提高锌的浸取效果,可以采取将焙烧后的产物碾碎,增大接触面积,以及增大硫酸的浓度等方式。
步骤 3:选择最适宜使用的X
A. NH_3•H_2O易分解产生NH_3污染空气,且经济成本较高,故A错误;
B. Ca(OH)_2不会引入新的杂质,且成本较低,故B正确;
C. NaOH会引入杂质Na^{+},且成本较高,故C错误;
步骤 4:滤渣①的主要成分
当沉淀完全时(离子浓度小于10^{-5}mol/L),结合表格K_sp计算各离子完全沉淀时pH<5的只有Fe^{3+},故滤渣①中有Fe(OH)_3,又CaSO_4是微溶物,SiO_2不溶于酸,故滤渣①的主要成分是Fe(OH)_3、CaSO_4、SiO_2。
步骤 5:向80~90℃滤液①中加入KMnO_4溶液的反应
向80~90℃滤液①中加入KMnO_4溶液,可氧化Fe^{2+},得到Fe(OH)_3和MnO_2的滤渣②,反应的离子方程式为3Fe^{2+}+${MnO}_{4}^{-}$+7H_2O=3Fe(OH)_3↓+MnO_2↓+5H^{+}。
步骤 6:滤液②中加入锌粉的目的
滤液②中加入锌粉,发生反应Zn+Cu^{2+}=Zn^{2+}=Cu,故加入锌粉的目的为置换Cu^{2+}为Cu从而除去。
步骤 7:滤渣④与浓H_2SO_4反应的副产物
由分析,滤渣④为CaF_2、MgF_2,与浓硫酸反应可得到HF,同时得到的副产物为CaSO_4、MgSO_4。