题目
已知25℃时 0.01mol/kg 和 0.1mol/kgNaCl 溶液中 ^+ 离子的平均迁移数是-|||-0.389。试计算下列二电池的电动势之差(可用浓度代替活度计算)。从计算结果中,你发现了-|||-什么?-|||-(1)Pt _(2)(101325Pa)|NaCl(0.1mol/kg) NaCl(0.01mol/kg )|Cl2(101325 Pa),Pt-|||-(2)Pt, _(2)(101325Pa)|NaCl(0.1mol/kg ), (0.01mol/kg) )|Cl2(101325 Pa),Pt

题目解答
答案
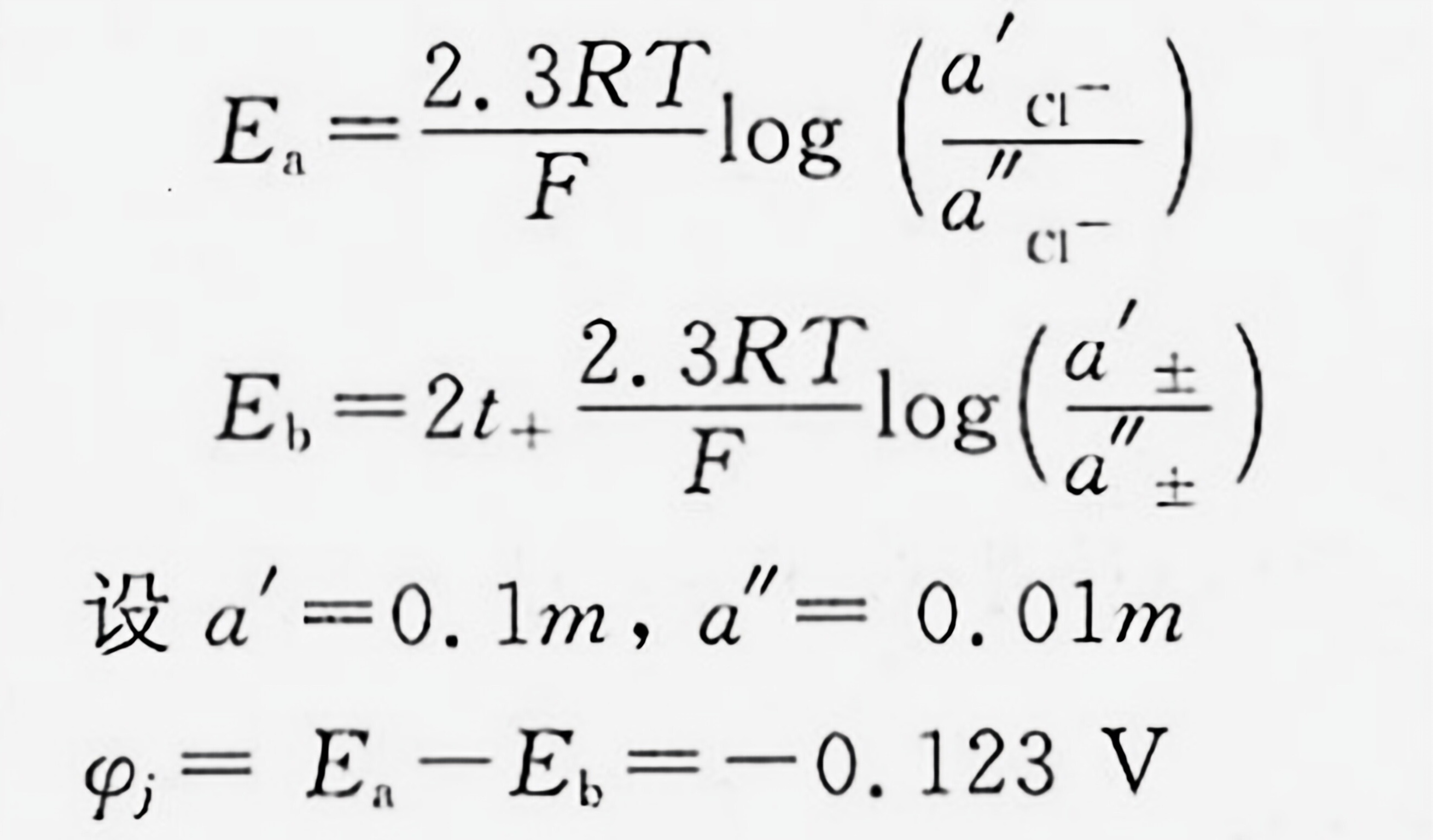
解析
步骤 1:计算电池 (1) 的电动势
根据能斯特方程,电池 (1) 的电动势 ${E}_{1}$ 可以表示为:
${E}_{1} = E_{cell}^{\circ} - \frac{RT}{nF} \ln Q$
其中,$E_{cell}^{\circ}$ 是标准电动势,$R$ 是气体常数,$T$ 是温度,$n$ 是电子转移数,$F$ 是法拉第常数,$Q$ 是反应商。
对于电池 (1),反应商 $Q$ 可以表示为:
$Q = \frac{[Cl^{-}]_{0.01mol/kg}^{2}}{[Cl^{-}]_{0.1mol/kg}^{2}}$
步骤 2:计算电池 (2) 的电动势
电池 (2) 的电动势 ${E}_{2}$ 可以表示为:
${E}_{2} = E_{cell}^{\circ} - \frac{RT}{nF} \ln Q$
其中,$Q$ 可以表示为:
$Q = \frac{[Cl^{-}]_{0.01mol/kg}^{2}}{[Cl^{-}]_{0.1mol/kg}^{2}}$
步骤 3:计算电动势之差
电动势之差 $\Delta E$ 可以表示为:
$\Delta E = {E}_{1} - {E}_{2}$
根据能斯特方程,电池 (1) 的电动势 ${E}_{1}$ 可以表示为:
${E}_{1} = E_{cell}^{\circ} - \frac{RT}{nF} \ln Q$
其中,$E_{cell}^{\circ}$ 是标准电动势,$R$ 是气体常数,$T$ 是温度,$n$ 是电子转移数,$F$ 是法拉第常数,$Q$ 是反应商。
对于电池 (1),反应商 $Q$ 可以表示为:
$Q = \frac{[Cl^{-}]_{0.01mol/kg}^{2}}{[Cl^{-}]_{0.1mol/kg}^{2}}$
步骤 2:计算电池 (2) 的电动势
电池 (2) 的电动势 ${E}_{2}$ 可以表示为:
${E}_{2} = E_{cell}^{\circ} - \frac{RT}{nF} \ln Q$
其中,$Q$ 可以表示为:
$Q = \frac{[Cl^{-}]_{0.01mol/kg}^{2}}{[Cl^{-}]_{0.1mol/kg}^{2}}$
步骤 3:计算电动势之差
电动势之差 $\Delta E$ 可以表示为:
$\Delta E = {E}_{1} - {E}_{2}$