题目
称取软锰矿0.1000g,试样经过烧碱熔后,得到MnO42-,煮沸溶液以除去过氧化物,酸化后,此时MnO42-歧化为MnO4-和MnO2,然后滤去MnO2,用0.1012mol/LFe2+标准溶液滴定MnO4-,用去25.80mL。计算试样中MnO2的质量分数(MMnO2=86.94)。
称取软锰矿0.1000g,试样经过烧碱熔后,得到MnO42-,煮沸溶液以除去过氧化物,酸化后,此时MnO42-歧化为MnO4-和MnO2,然后滤去MnO2,用0.1012mol/LFe2+标准溶液滴定MnO4-,用去25.80mL。计算试样中MnO2的质量分数(MMnO2=86.94)。
题目解答
答案
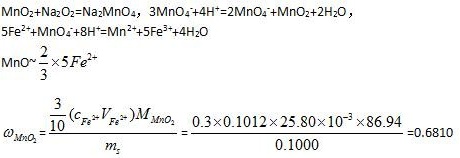
解析
步骤 1:确定反应方程式
软锰矿中的MnO_2在烧碱熔融条件下生成MnO_4^{2-},然后在酸性条件下歧化为MnO_4^{-}和MnO_2。MnO_4^{-}与Fe^{2+}反应的方程式为:
$$5Fe^{2+} + MnO_4^{-} + 8H^{+} \rightarrow Mn^{2+} + 5Fe^{3+} + 4H_2O$$
步骤 2:计算MnO_4^{-}的物质的量
根据Fe^{2+}标准溶液的浓度和体积,可以计算出MnO_4^{-}的物质的量:
$$n(MnO_4^{-}) = \frac{1}{5} \times n(Fe^{2+}) = \frac{1}{5} \times 0.1012 \times 25.80 \times 10^{-3}$$
步骤 3:计算MnO_2的质量分数
根据MnO_4^{-}的物质的量和MnO_2的摩尔质量,可以计算出MnO_2的质量分数:
$$\omega(MnO_2) = \frac{m(MnO_2)}{m(试样)} = \frac{n(MnO_4^{-}) \times M(MnO_2)}{m(试样)}$$
软锰矿中的MnO_2在烧碱熔融条件下生成MnO_4^{2-},然后在酸性条件下歧化为MnO_4^{-}和MnO_2。MnO_4^{-}与Fe^{2+}反应的方程式为:
$$5Fe^{2+} + MnO_4^{-} + 8H^{+} \rightarrow Mn^{2+} + 5Fe^{3+} + 4H_2O$$
步骤 2:计算MnO_4^{-}的物质的量
根据Fe^{2+}标准溶液的浓度和体积,可以计算出MnO_4^{-}的物质的量:
$$n(MnO_4^{-}) = \frac{1}{5} \times n(Fe^{2+}) = \frac{1}{5} \times 0.1012 \times 25.80 \times 10^{-3}$$
步骤 3:计算MnO_2的质量分数
根据MnO_4^{-}的物质的量和MnO_2的摩尔质量,可以计算出MnO_2的质量分数:
$$\omega(MnO_2) = \frac{m(MnO_2)}{m(试样)} = \frac{n(MnO_4^{-}) \times M(MnO_2)}{m(试样)}$$