题目
5.有氮气和甲烷的气体混合物100g,已知氮气的质量分数为0.31。在420K和一定压强下,混合气体-|||-的体积为9.95 dm^3。求混合气体的总压和各组分的分压。假定混合气体遵守道尔顿分压定律。已知氮气和甲-|||-烷的摩尔质量分别为 cdot (mol)^-1 和 cdot (mol)^-1

题目解答
答案
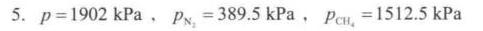
解析
考查要点:本题主要考查理想气体状态方程的应用及道尔顿分压定律的理解,涉及混合气体的总压和分压计算。
解题核心思路:
- 确定各组分物质的量:根据质量分数和摩尔质量,分别计算氮气和甲烷的物质的量。
- 计算总物质的量:将两组分的物质的量相加。
- 应用理想气体方程求总压:利用公式 $PV = n_{\text{总}}RT$,代入已知条件求总压。
- 应用道尔顿分压定律求分压:分压等于总压乘以该组分的物质的量分数。
破题关键点:
- 区分质量分数与物质的量分数:分压计算必须基于物质的量分数,而非质量分数。
- 单位统一:体积单位需与气体常数 $R$ 的单位匹配(本题中 $R = 8.314 \, \text{dm}^3 \cdot \text{kPa} \cdot \text{mol}^{-1} \cdot \text{K}^{-1}$)。
1. 计算各组分物质的量
-
氮气的质量:
$m_{N_2} = 100 \, \text{g} \times 0.31 = 31 \, \text{g}$
物质的量:
$n_{N_2} = \frac{31}{28} \approx 1.107 \, \text{mol}$ -
甲烷的质量:
$m_{CH_4} = 100 \, \text{g} - 31 \, \text{g} = 69 \, \text{g}$
物质的量:
$n_{CH_4} = \frac{69}{16} \approx 4.3125 \, \text{mol}$
2. 计算总物质的量
$n_{\text{总}} = n_{N_2} + n_{CH_4} = 1.107 + 4.3125 \approx 5.4195 \, \text{mol}$
3. 应用理想气体方程求总压
公式:
$P = \frac{n_{\text{总}}RT}{V}$
代入数据:
$R = 8.314 \, \text{dm}^3 \cdot \text{kPa} \cdot \text{mol}^{-1} \cdot \text{K}^{-1}, \quad T = 420 \, \text{K}, \quad V = 9.95 \, \text{dm}^3$
$P = \frac{5.4195 \times 8.314 \times 420}{9.95} \approx 1902 \, \text{kPa}$
4. 应用道尔顿分压定律求分压
- 氮气的分压:
$P_{N_2} = P \times \frac{n_{N_2}}{n_{\text{总}}} = 1902 \times \frac{1.107}{5.4195} \approx 389.5 \, \text{kPa}$ - 甲烷的分压:
$P_{CH_4} = P \times \frac{n_{CH_4}}{n_{\text{总}}} = 1902 \times \frac{4.3125}{5.4195} \approx 1512.5 \, \text{kPa}$