题目
12.在373K和101.325 kPa时,有1molH2O(1)可逆蒸发成同温、同压的H2 O(g),已知H2O(1)的摩尔气-|||-化烙 (Delta )_(四P)(H)_(m)=40.66kJcdot mo(l)^-1-|||-(1)试计算该过程的Q,W和 Delta (W)_(p)(V)_(m), 可以忽略液态水的体积。-|||-(2)比较 Delta (mu )_(m)(H)_(m) 与 Delta (W)_(p)(C)_(m) 的大小,并说明原因。

题目解答
答案
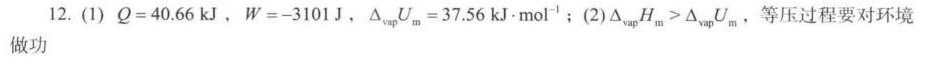
解析
步骤 1:计算Q
在等温等压条件下,1mol H2O(l)可逆蒸发成同温同压的H2O(g),其摩尔气化焓 ${\Delta }_{mpp}{H}_{m}=40.66kJ\cdot {mol}^{-1}$ ,即为该过程的热量Q。
步骤 2:计算W
根据热力学第一定律,Q = ΔU + W,其中ΔU为内能变化,W为功。在等温等压条件下,ΔU = ΔH - PΔV,其中ΔH为焓变,P为压力,ΔV为体积变化。由于ΔH = ${\Delta }_{mpp}{H}_{m}$,且可以忽略液态水的体积,因此ΔV = V(g) - V(l) ≈ V(g)。根据理想气体状态方程,V(g) = nRT/P,其中n为物质的量,R为气体常数,T为温度。将已知数值代入,得到V(g) = 1mol × 8.314J/(mol·K) × 373K / 101.325kPa = 30.6L。因此,ΔV = 30.6L = 0.0306m³。将已知数值代入,得到W = -PΔV = -101.325kPa × 0.0306m³ = -3101J。
步骤 3:计算ΔV
根据步骤2,ΔV = 30.6L = 0.0306m³。
步骤 4:比较ΔH与ΔU的大小
根据步骤2,ΔH = ${\Delta }_{mpp}{H}_{m}$ = 40.66kJ,ΔU = ΔH - PΔV = 40.66kJ - (-3101J) = 37.56kJ。因此,ΔH > ΔU。
在等温等压条件下,1mol H2O(l)可逆蒸发成同温同压的H2O(g),其摩尔气化焓 ${\Delta }_{mpp}{H}_{m}=40.66kJ\cdot {mol}^{-1}$ ,即为该过程的热量Q。
步骤 2:计算W
根据热力学第一定律,Q = ΔU + W,其中ΔU为内能变化,W为功。在等温等压条件下,ΔU = ΔH - PΔV,其中ΔH为焓变,P为压力,ΔV为体积变化。由于ΔH = ${\Delta }_{mpp}{H}_{m}$,且可以忽略液态水的体积,因此ΔV = V(g) - V(l) ≈ V(g)。根据理想气体状态方程,V(g) = nRT/P,其中n为物质的量,R为气体常数,T为温度。将已知数值代入,得到V(g) = 1mol × 8.314J/(mol·K) × 373K / 101.325kPa = 30.6L。因此,ΔV = 30.6L = 0.0306m³。将已知数值代入,得到W = -PΔV = -101.325kPa × 0.0306m³ = -3101J。
步骤 3:计算ΔV
根据步骤2,ΔV = 30.6L = 0.0306m³。
步骤 4:比较ΔH与ΔU的大小
根据步骤2,ΔH = ${\Delta }_{mpp}{H}_{m}$ = 40.66kJ,ΔU = ΔH - PΔV = 40.66kJ - (-3101J) = 37.56kJ。因此,ΔH > ΔU。