题目
15.把1 mol He在127℃和0.5 MPa下恒温压缩至1MP a,试求其-|||-Q、W、 △U 、 Delta H 、 △S 、 Delta A 、 △G。 He 可作为理想气体。(1)设为-|||-可逆过程;(2)设压缩时外压自始至终为1MPa。

题目解答
答案
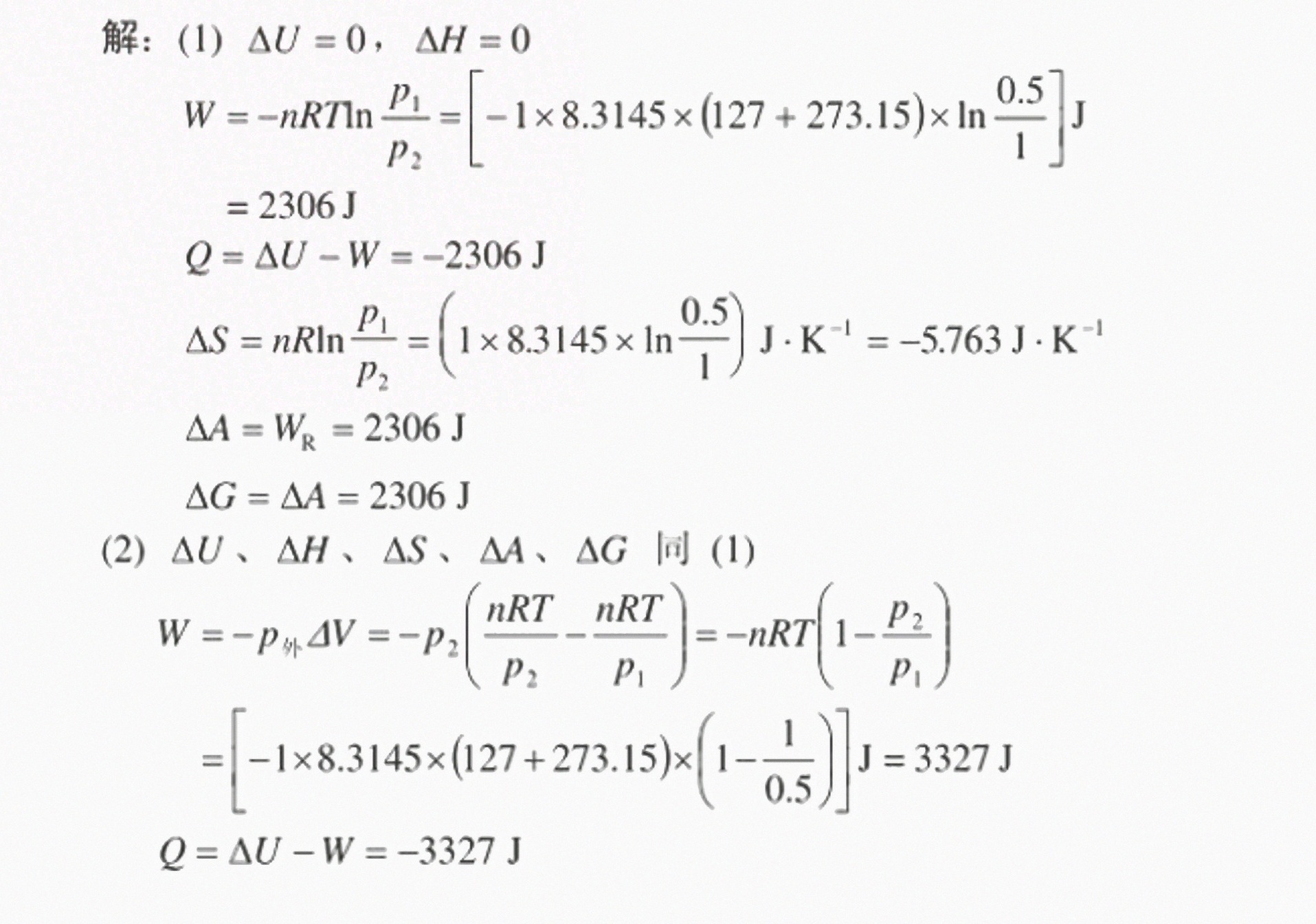
解析
考查要点:本题主要考查理想气体在恒温条件下的可逆与不可逆压缩过程中的热力学函数计算,包括功、热量、内能、焓、熵、赫姆霍兹自由能和吉布斯自由能的变化。
解题核心思路:
- 状态函数性质:$\Delta U$、$\Delta H$、$\Delta S$、$\Delta A$、$\Delta G$均为状态函数,与过程无关,仅由初态和终态决定。
- 恒温条件:对于理想气体,$\Delta U = nC_v \Delta T = 0$,$\Delta H = nC_p \Delta T = 0$。
- 可逆过程:功、热量、熵变可通过可逆公式计算;不可逆过程需单独计算功和热量,但状态函数变化与可逆过程相同。
破题关键点:
- 可逆过程:利用公式 $W = -nRT \ln \frac{P_2}{P_1}$,$\Delta S = nR \ln \frac{P_1}{P_2}$。
- 不可逆过程:功为 $W = -P_{\text{外}} \Delta V$,热量通过第一定律计算。
(1) 可逆过程
计算 $\Delta U$ 和 $\Delta H$
- 恒温条件下,$\Delta U = nC_v \Delta T = 0$,$\Delta H = nC_p \Delta T = 0$。
计算功 $W$
- 可逆压缩功公式:
$W = -nRT \ln \frac{P_2}{P_1} = -1 \cdot 8.3145 \cdot 400 \cdot \ln 2 \approx -2306 \, \text{J}.$
计算热量 $Q$
- 根据第一定律 $\Delta U = Q + W$,得:
$Q = -W = -(-2306) = -2306 \, \text{J}.$
计算熵变 $\Delta S$
- 恒温过程熵变公式:
$\Delta S = nR \ln \frac{P_1}{P_2} = 1 \cdot 8.3145 \cdot \ln \frac{0.5}{1} \approx -5.763 \, \text{J/K}.$
计算 $\Delta A$ 和 $\Delta G$
- 可逆过程下,$\Delta A = W_{\text{非膨胀}} = 2306 \, \text{J}$,$\Delta G = \Delta A = 2306 \, \text{J}$。
(2) 不可逆过程(外压恒为 $1 \, \text{MPa}$)
计算 $\Delta U$、$\Delta H$、$\Delta S$、$\Delta A$、$\Delta G$
- 与可逆过程相同,均为 $0$ 或对应值。
计算功 $W$
- 外压恒定,功公式:
$W = -P_{\text{外}} \Delta V = -P_2 \left( \frac{nRT}{P_2} - \frac{nRT}{P_1} \right) = -nRT \left( 1 - \frac{P_2}{P_1} \right).$
代入数据得:
$W = -1 \cdot 8.3145 \cdot 400 \cdot (1 - 2) = 3327 \, \text{J}.$
计算热量 $Q$
- 根据第一定律 $\Delta U = Q + W$,得:
$Q = -W = -3327 \, \text{J}.$