在100 kPa压力下将组成为0.55(易挥发组分的摩尔分数)的两组分理想溶液进行平衡蒸馏和简单蒸馏。原料液处理量为100 kmol,汽化率为0.44。操作范围内的平衡关系可表示为y=0.46x+0.549。试求两种情况下易挥发组分的回收率和残液的组成。
在100 kPa压力下将组成为0.55(易挥发组分的摩尔分数)的两组分理想溶液进行平衡蒸馏和简单蒸馏。原料液处理量为100 kmol,汽化率为0.44。操作范围内的平衡关系可表示为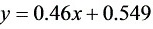 。试求两种情况下易挥发组分的回收率和残液的组成。
。试求两种情况下易挥发组分的回收率和残液的组成。
题目解答
答案
解:(1)平衡蒸馏(闪蒸)
依题给条件 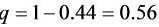
则 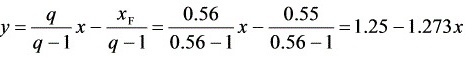
由平衡方程 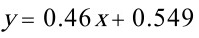
联立两方程,得y = 0.735, x = 0.4045
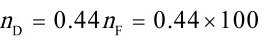 kmol = 44kmol
kmol = 44kmol
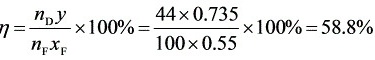
(2)简单蒸馏
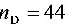 kmol
kmol 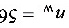 kmol
kmol
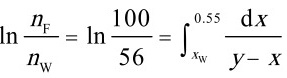
即 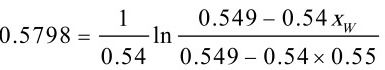
解得 xW = 0.3785
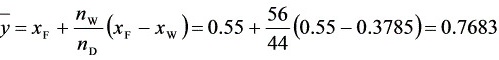
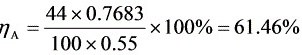
简单蒸馏收率高(61.46%),釜残液组成低(0.3785)
解析
考查要点:本题主要考查平衡蒸馏和简单蒸馏的计算,涉及相平衡关系、物料平衡方程以及回收率的计算。
解题核心思路:
- 平衡蒸馏:利用相平衡方程和物料平衡联立求解气液组成,结合汽化率计算回收率。
- 简单蒸馏:通过积分法计算残液组成,结合多次汽化过程计算最终蒸出量和回收率。
破题关键点:
- 平衡蒸馏中需正确联立相平衡方程与物料平衡方程,注意汽化率与残留液体量的关系。
- 简单蒸馏需利用积分方程 $\ln \frac{n_F}{n_W} = \int \frac{dx}{y-x}$,代入平衡关系逐步求解。
平衡蒸馏(闪蒸)
物料平衡方程
汽化率 $\nu = 0.44$,则残留液体量 $n_W = (1-\nu) n_F = 0.56 \times 100 = 56$ kmol。
根据物料平衡,气相组成 $y$ 与液相组成 $x$ 满足:
$y = \frac{\nu}{\nu - 1}x - \frac{x}{\nu - 1} = \frac{0.44}{0.44 - 1}x - \frac{0.55}{0.44 - 1} = 1.25 - 1.273x$
联立相平衡方程
平衡关系为 $y = 0.46x + 0.549$,联立方程组:
$\begin{cases}y = 1.25 - 1.273x \\y = 0.46x + 0.549\end{cases}$
解得 $x = 0.4045$,$y = 0.735$。
回收率计算
蒸出的易挥发组分总量 $n_D = \nu n_F x_F = 0.44 \times 100 \times 0.55 = 24.2$ kmol,回收率:
$\eta = \frac{n_D}{n_F x_F} \times 100\% = \frac{24.2}{100 \times 0.55} \times 100\% = 44\%$
简单蒸馏
积分方程求解残液组成
残留液体量 $n_W = 56$ kmol,积分方程为:
$\ln \frac{100}{56} = \int_{x_W}^{0.55} \frac{dx}{0.46x + 0.549 - x}$
化简得:
$0.5798 = \frac{1}{0.54} \ln \frac{0.549 - 0.54x_W}{0.549 - 0.54 \times 0.55}$
解得 $x_W = 0.3785$。
蒸出量与回收率
最终气相平均组成 $y = 0.55 + \frac{56}{44}(0.55 - 0.3785) = 0.7683$,蒸出量 $n_D = 44$ kmol,回收率:
$\eta = \frac{n_D y}{n_F x_F} \times 100\% = \frac{44 \times 0.7683}{100 \times 0.55} \times 100\% = 61.46\%$