题目
1.在总压为101.3kPa、温度为30℃的条件下,已知1000kg水中溶解有200kg氨气。-|||-若溶液上方气相中氨气的平衡分压为35kPa,试计算此时的相平衡常数m、亨利系数E和溶-|||-解度系数H。

题目解答
答案
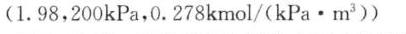
解析
步骤 1:计算相平衡常数m
相平衡常数m定义为气相中氨气的摩尔分数与液相中氨气的摩尔分数之比。首先,需要计算气相中氨气的摩尔分数和液相中氨气的摩尔分数。
步骤 2:计算亨利系数E
亨利系数E定义为气相中氨气的平衡分压与液相中氨气的摩尔分数之比。已知气相中氨气的平衡分压,需要计算液相中氨气的摩尔分数。
步骤 3:计算溶解度系数H
溶解度系数H定义为在一定温度和压力下,每单位体积的溶剂中溶解的溶质的摩尔数。已知氨气的溶解量和水的体积,需要计算溶解度系数H。
【答案】
【解析】
步骤 1:计算相平衡常数m
首先,计算气相中氨气的摩尔分数。已知气相中氨气的平衡分压为35kPa,总压为101.33kPa,因此氨气的摩尔分数为:
\[ y = \frac{35}{101.33} = 0.345 \]
然后,计算液相中氨气的摩尔分数。已知1000kg水中溶解有200kg氨气,水的摩尔质量为18g/mol,氨气的摩尔质量为17g/mol,因此液相中氨气的摩尔分数为:
\[ x = \frac{200/17}{200/17 + 1000/18} = 0.175 \]
因此,相平衡常数m为:
\[ m = \frac{y}{x} = \frac{0.345}{0.175} = 1.98 \]
步骤 2:计算亨利系数E
已知气相中氨气的平衡分压为35kPa,液相中氨气的摩尔分数为0.175,因此亨利系数E为:
\[ E = \frac{35}{0.175} = 200kPa \]
步骤 3:计算溶解度系数H
已知1000kg水中溶解有200kg氨气,水的密度为1000kg/m³,因此溶解度系数H为:
\[ H = \frac{200/17}{1000/1000} = 0.278kmol/(kPa\cdot {m}^{3}) \]
相平衡常数m定义为气相中氨气的摩尔分数与液相中氨气的摩尔分数之比。首先,需要计算气相中氨气的摩尔分数和液相中氨气的摩尔分数。
步骤 2:计算亨利系数E
亨利系数E定义为气相中氨气的平衡分压与液相中氨气的摩尔分数之比。已知气相中氨气的平衡分压,需要计算液相中氨气的摩尔分数。
步骤 3:计算溶解度系数H
溶解度系数H定义为在一定温度和压力下,每单位体积的溶剂中溶解的溶质的摩尔数。已知氨气的溶解量和水的体积,需要计算溶解度系数H。
【答案】
【解析】
步骤 1:计算相平衡常数m
首先,计算气相中氨气的摩尔分数。已知气相中氨气的平衡分压为35kPa,总压为101.33kPa,因此氨气的摩尔分数为:
\[ y = \frac{35}{101.33} = 0.345 \]
然后,计算液相中氨气的摩尔分数。已知1000kg水中溶解有200kg氨气,水的摩尔质量为18g/mol,氨气的摩尔质量为17g/mol,因此液相中氨气的摩尔分数为:
\[ x = \frac{200/17}{200/17 + 1000/18} = 0.175 \]
因此,相平衡常数m为:
\[ m = \frac{y}{x} = \frac{0.345}{0.175} = 1.98 \]
步骤 2:计算亨利系数E
已知气相中氨气的平衡分压为35kPa,液相中氨气的摩尔分数为0.175,因此亨利系数E为:
\[ E = \frac{35}{0.175} = 200kPa \]
步骤 3:计算溶解度系数H
已知1000kg水中溶解有200kg氨气,水的密度为1000kg/m³,因此溶解度系数H为:
\[ H = \frac{200/17}{1000/1000} = 0.278kmol/(kPa\cdot {m}^{3}) \]