题目
种类繁多的金属材料已成为社会发展的重要物质基础。(一)金属材料在生产生活中的应用(1)①“三星堆遗址”出土了黄金面罩、象牙、青铜艺术品、残存的丝织品等重要文物,其中属于金属材料的有 ____ (选填序号)。a.黄金面罩b.象牙c.青铜面具d.丝织品②《吕氏春秋•别类篇》载有“金(铜)柔锡柔,合两柔则刚”,表明青铜的硬度比纯铜 ____ (选填“大”或“小”)。(2)2022年6月17日,我国第三艘航母下水命名。航母的飞行甲板,既能承受舰载机起降时产生的强烈冲击和摩擦,也能承受舰载机的尾焰炙烤,还能遭受潮湿盐雾的海洋大气环境侵蚀。由此可推知,制造飞行甲板的材料具有的性质是 ____ 。A.耐高温B.良好的导电性C.耐腐蚀D.硬度大(3)金属材料在使用时常常因为锈蚀而影响其使用寿命。①探究铁锈蚀的实验中,试管 ____ (填字母)中的铁钉最易生锈。通过对比试管A、C中的现象,可以得出铁生锈需要与 ____ 接触。迅速冷-|||--铁钉 却的沸水-|||-干棉花 -铁钉 蒸馏水-|||--铁钉-|||-干燥剂-|||-A B C-|||-图1②铁合金是目前世界上应用最广泛的金属材料。为防止铁制品生锈,通常采取的具体措施 ____ 。③铝的“自我保护”是指铝在常温下与空气中的氧气反应形成一层致密的氧化膜。写出发生反应的化学方程式: ____ 。(二)金属的冶炼迅速冷-|||--铁钉 却的沸水-|||-干棉花 -铁钉 蒸馏水-|||--铁钉-|||-干燥剂-|||-A B C-|||-图1(4)金属的冶炼。如图2是实验室仿照工业炼铁原理设计的实验。①硬质玻璃管内物质为磁铁矿,则硬质玻璃管中发生主要反应的化学方程式是 ____ 。②C装置的作用是 ____ 。③有同学觉得原方案浪费资源,因此设计出如图3所示的改进装置。已知甲装置是为了防倒吸的,则乙装置的作用是 ____ 、 ____ 。(5)古代金属铜的冶炼方法有很多种《淮南万毕术》中记载“曾青得铁则化为铜”,先用孔雀石制取硫酸铜,再用“湿法炼铜”获得铜。其流程如图4:迅速冷-|||--铁钉 却的沸水-|||-干棉花 -铁钉 蒸馏水-|||--铁钉-|||-干燥剂-|||-A B C-|||-图1①孔雀石需要粉碎,这样做的目的是 ____ 。步骤a的反应方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,加入的稀硫酸需过量的目的是 ____ 。②步骤b中发生反应的化学方程式 ____ (任写一个),固体B的成分 ____ 。(三)含铜化合物组成的探究(6)铜是人类最早使用的金属之一。铜也会氧化锈蚀,铜锈的主要成分可用Cux(OH)y(CO3)z表示。根据化学式可推测铜生锈很可能与空气中的氧气、二氧化碳和 ____ 有关。某同学为了验证这一猜想设计出如图实验。对比实验 ____ (选填两组实验编号),可判断铜锈的产生需要CO2参加。迅速冷-|||--铁钉 却的沸水-|||-干棉花 -铁钉 蒸馏水-|||--铁钉-|||-干燥剂-|||-A B C-|||-图1某同学对铜锈主要成分的化学式产生了浓厚兴趣。为探究其组成,用如图装置对27.1g纯净的样品进行热分解实验,观察到样品固体先变成黑色,然后部分出现红色。资料:①浓硫酸具有吸水性,浓氢氧化钠溶液能充分吸收CO2。②CuO加热会分解生成红色的Cu2O和O2。实验步骤:①连接好装置并 ____ ;②A中装入27.1克样品,其它各装置装入足量相应药品;③通入一段时间氮气,分别称量装置A、B、C、D的质量;④打开A处电加热器进行加热;⑤一段时间后观察到A中有红色物质出现,打开活塞通入N2并关闭电加热器;⑥继续通入氮气直到冷却;⑦再次称量装置A、B、C、D的质量。(7)补全步骤①中的操作 ____ 。(8)D装置中的实验现象是 ____ 。(9)停止加热后仍需继续通N2,目的是 ____ 和防止倒吸。(10)测得实验前后各装置的质量变化如表。 温度/℃ 装置A 装置B 装置C 装置D 实验前/g 227.1 100.0 100.0 100.0 实验后/g 219.0 102.7 104.4 101.0 ①该碱式碳酸铜的化学式中x:y:z= ____ (最简整数比)。②最后装置A剩余固体中铜、氧元素质量比 ____ (最简整数比)。
种类繁多的金属材料已成为社会发展的重要物质基础。
(一)金属材料在生产生活中的应用
(1)①“三星堆遗址”出土了黄金面罩、象牙、青铜艺术品、残存的丝织品等重要文物,其中属于金属材料的有 ____ (选填序号)。
a.黄金面罩
b.象牙
c.青铜面具
d.丝织品
②《吕氏春秋•别类篇》载有“金(铜)柔锡柔,合两柔则刚”,表明青铜的硬度比纯铜 ____ (选填“大”或“小”)。
(2)2022年6月17日,我国第三艘航母下水命名。航母的飞行甲板,既能承受舰载机起降时产生的强烈冲击和摩擦,也能承受舰载机的尾焰炙烤,还能遭受潮湿盐雾的海洋大气环境侵蚀。由此可推知,制造飞行甲板的材料具有的性质是 ____ 。
A.耐高温
B.良好的导电性
C.耐腐蚀
D.硬度大
(3)金属材料在使用时常常因为锈蚀而影响其使用寿命。
①探究铁锈蚀的实验中,试管 ____ (填字母)中的铁钉最易生锈。通过对比试管A、C中的现象,可以得出铁生锈需要与 ____ 接触。
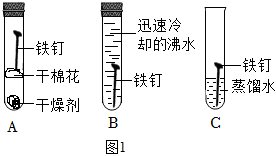
②铁合金是目前世界上应用最广泛的金属材料。为防止铁制品生锈,通常采取的具体措施 ____ 。
③铝的“自我保护”是指铝在常温下与空气中的氧气反应形成一层致密的氧化膜。写出发生反应的化学方程式: ____ 。
(二)金属的冶炼
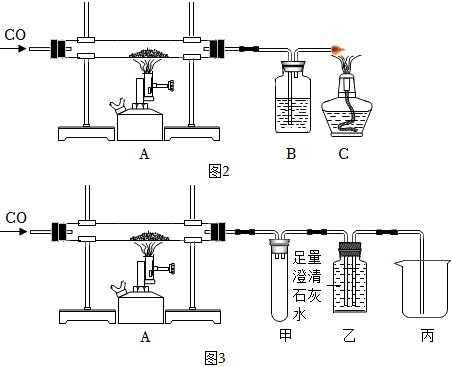
(4)金属的冶炼。如图2是实验室仿照工业炼铁原理设计的实验。
①硬质玻璃管内物质为磁铁矿,则硬质玻璃管中发生主要反应的化学方程式是 ____ 。
②C装置的作用是 ____ 。
③有同学觉得原方案浪费资源,因此设计出如图3所示的改进装置。已知甲装置是为了防倒吸的,则乙装置的作用是 ____ 、 ____ 。
(5)古代金属铜的冶炼方法有很多种
《淮南万毕术》中记载“曾青得铁则化为铜”,先用孔雀石制取硫酸铜,再用“湿法炼铜”获得铜。其流程如图4:

①孔雀石需要粉碎,这样做的目的是 ____ 。步骤a的反应方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,加入的稀硫酸需过量的目的是 ____ 。
②步骤b中发生反应的化学方程式 ____ (任写一个),固体B的成分 ____ 。
(三)含铜化合物组成的探究
(6)铜是人类最早使用的金属之一。铜也会氧化锈蚀,铜锈的主要成分可用Cux(OH)y(CO3)z表示。根据化学式可推测铜生锈很可能与空气中的氧气、二氧化碳和 ____ 有关。某同学为了验证这一猜想设计出如图实验。对比实验 ____ (选填两组实验编号),可判断铜锈的产生需要CO2参加。
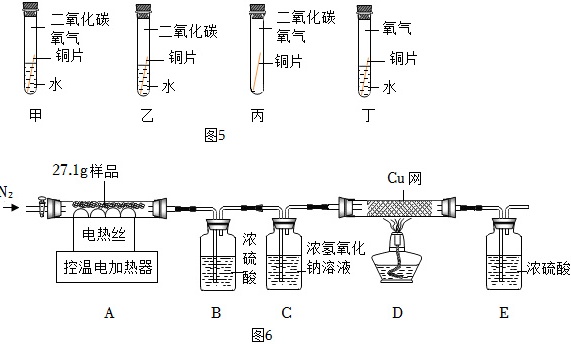
某同学对铜锈主要成分的化学式产生了浓厚兴趣。为探究其组成,用如图装置对27.1g纯净的样品进行热分解实验,观察到样品固体先变成黑色,然后部分出现红色。
资料:①浓硫酸具有吸水性,浓氢氧化钠溶液能充分吸收CO2。
②CuO加热会分解生成红色的Cu2O和O2。
实验步骤:①连接好装置并 ____ ;
②A中装入27.1克样品,其它各装置装入足量相应药品;
③通入一段时间氮气,分别称量装置A、B、C、D的质量;
④打开A处电加热器进行加热;
⑤一段时间后观察到A中有红色物质出现,打开活塞通入N2并关闭电加热器;
⑥继续通入氮气直到冷却;
⑦再次称量装置A、B、C、D的质量。
(7)补全步骤①中的操作 ____ 。
(8)D装置中的实验现象是 ____ 。
(9)停止加热后仍需继续通N2,目的是 ____ 和防止倒吸。
(10)测得实验前后各装置的质量变化如表。
①该碱式碳酸铜的化学式中x:y:z= ____ (最简整数比)。
②最后装置A剩余固体中铜、氧元素质量比 ____ (最简整数比)。
(一)金属材料在生产生活中的应用
(1)①“三星堆遗址”出土了黄金面罩、象牙、青铜艺术品、残存的丝织品等重要文物,其中属于金属材料的有 ____ (选填序号)。
a.黄金面罩
b.象牙
c.青铜面具
d.丝织品
②《吕氏春秋•别类篇》载有“金(铜)柔锡柔,合两柔则刚”,表明青铜的硬度比纯铜 ____ (选填“大”或“小”)。
(2)2022年6月17日,我国第三艘航母下水命名。航母的飞行甲板,既能承受舰载机起降时产生的强烈冲击和摩擦,也能承受舰载机的尾焰炙烤,还能遭受潮湿盐雾的海洋大气环境侵蚀。由此可推知,制造飞行甲板的材料具有的性质是 ____ 。
A.耐高温
B.良好的导电性
C.耐腐蚀
D.硬度大
(3)金属材料在使用时常常因为锈蚀而影响其使用寿命。
①探究铁锈蚀的实验中,试管 ____ (填字母)中的铁钉最易生锈。通过对比试管A、C中的现象,可以得出铁生锈需要与 ____ 接触。

②铁合金是目前世界上应用最广泛的金属材料。为防止铁制品生锈,通常采取的具体措施 ____ 。
③铝的“自我保护”是指铝在常温下与空气中的氧气反应形成一层致密的氧化膜。写出发生反应的化学方程式: ____ 。
(二)金属的冶炼

(4)金属的冶炼。如图2是实验室仿照工业炼铁原理设计的实验。
①硬质玻璃管内物质为磁铁矿,则硬质玻璃管中发生主要反应的化学方程式是 ____ 。
②C装置的作用是 ____ 。
③有同学觉得原方案浪费资源,因此设计出如图3所示的改进装置。已知甲装置是为了防倒吸的,则乙装置的作用是 ____ 、 ____ 。
(5)古代金属铜的冶炼方法有很多种
《淮南万毕术》中记载“曾青得铁则化为铜”,先用孔雀石制取硫酸铜,再用“湿法炼铜”获得铜。其流程如图4:

①孔雀石需要粉碎,这样做的目的是 ____ 。步骤a的反应方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,加入的稀硫酸需过量的目的是 ____ 。
②步骤b中发生反应的化学方程式 ____ (任写一个),固体B的成分 ____ 。
(三)含铜化合物组成的探究
(6)铜是人类最早使用的金属之一。铜也会氧化锈蚀,铜锈的主要成分可用Cux(OH)y(CO3)z表示。根据化学式可推测铜生锈很可能与空气中的氧气、二氧化碳和 ____ 有关。某同学为了验证这一猜想设计出如图实验。对比实验 ____ (选填两组实验编号),可判断铜锈的产生需要CO2参加。

某同学对铜锈主要成分的化学式产生了浓厚兴趣。为探究其组成,用如图装置对27.1g纯净的样品进行热分解实验,观察到样品固体先变成黑色,然后部分出现红色。
资料:①浓硫酸具有吸水性,浓氢氧化钠溶液能充分吸收CO2。
②CuO加热会分解生成红色的Cu2O和O2。
实验步骤:①连接好装置并 ____ ;
②A中装入27.1克样品,其它各装置装入足量相应药品;
③通入一段时间氮气,分别称量装置A、B、C、D的质量;
④打开A处电加热器进行加热;
⑤一段时间后观察到A中有红色物质出现,打开活塞通入N2并关闭电加热器;
⑥继续通入氮气直到冷却;
⑦再次称量装置A、B、C、D的质量。
(7)补全步骤①中的操作 ____ 。
(8)D装置中的实验现象是 ____ 。
(9)停止加热后仍需继续通N2,目的是 ____ 和防止倒吸。
(10)测得实验前后各装置的质量变化如表。
| 温度/℃ | 装置A | 装置B | 装置C | 装置D |
| 实验前/g | 227.1 | 100.0 | 100.0 | 100.0 |
| 实验后/g | 219.0 | 102.7 | 104.4 | 101.0 |
②最后装置A剩余固体中铜、氧元素质量比 ____ (最简整数比)。
题目解答
答案
解:(1)①“三星堆遗址”出土了黄金面罩、青铜面具属于金属材料,故选:ac;
②《吕氏春秋•别类篇》载有“金(铜)柔锡柔,合两柔则刚”,表明青铜的硬度比纯铜大;故答案为:大;
(2)2022年6月17日,我国第三艘航母下水命名。航母的飞行甲板,既能承受舰载机起降时产生的强烈冲击和摩擦,也能承受舰载机的尾焰炙烤,还能遭受潮湿盐雾的海洋大气环境侵蚀。由此可推知,制造飞行甲板的材料具有的性质是:耐高温;耐腐蚀;硬度大,故选:ACD;
(3)①探究铁锈蚀的实验中,试管C中的铁钉同时与水和氧气接触,所以最易生锈。通过对比试管A、C中的现象,可以得出铁生锈需要与水接触。故答案为:C;水;
②铁合金是目前世界上应用最广泛的金属材料。为防止铁制品生锈,通常采取的具体措施:涂漆、涂油、制成合金、镀一层金属等。故答案为:涂漆、涂油、制成合金、镀一层金属等;
③铝与氧气反应生成氧化铝,化学方程式:4Al+3O2=2Al2O3。故答案为:4Al+3O2=2Al2O3;
(4)①磁铁矿的主要成分是Fe3O4,则硬质玻璃管中发生主要反应的化学方程式是:Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2。故答案为:Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2;
②由于CO有毒,污染空气,所以C装置的作用是处理尾气。故答案为:处理尾气;
③甲装置是为了防倒吸的,则乙装置的作用是吸收二氧化碳、收集一氧化碳。故答案为:吸收二氧化碳、收集一氧化碳;
(5)①孔雀石需要粉碎,这样做的目的是扩大反应接触面积。加入的稀硫酸需过量的目的是使孔雀石反应完全。故答案为:扩大反应接触面积;使孔雀石反应完全;
②步骤b中发生反应是铁与硫酸铜反应置换出铜,化学方程式 Fe+CuSO4═FeSO4+Cu,所以固体B的成分铁粉和铜。故答案为:Fe+CuSO4═FeSO4+Cu;铁粉和铜;
(6)根据铜锈的主要成分可用Cux(OH)y(CO3)z化学式可知,除了铜元素外,还含有C、H、O元素,故可推测铜生锈很可能与空气中的氧气、二氧化碳和水有关。判断铜锈的产生需要CO2参加,则说明实验的变量是二氧化碳,故对比实验为:甲丁;故答案为:水;甲丁;
实验步骤:①有气体参加的反应,实验装置连接好后先要检查装置的气密性;故答案为:检验装置的气密性;
(7)步骤①中的操作是检验装置的气密性,方法是:对A装置加热,如果B、C、E装置内的导管都冒出气泡,停止加热后,B、C、E装置内长的导管形成一段水柱,说明装置气密性良好。故答案为:对A装置加热,如果B、C、E装置内的导管都冒出气泡,停止加热后,B、C、E装置内长的导管形成一段水柱,说明装置气密性良好;
(8)铜和氧气加热生成黑色氧化铜,D装置中的实验现象是红色固体变为黑色;故答案为:红色固体变为黑色;
(9)停止加热后仍需继续通N2,为了使测定结果更准确,因此应将生成的水、二氧化碳和氧气全部赶到后面的装置中,分别被B、C、D装置充分吸收;因此停止加热后仍需继续通N2,除可防止倒吸,还能使生成的水、二氧化碳和氧气分别被B、C、D装置充分吸收。故答案为:将生成的水、二氧化碳和氧气全部赶到后面的装置中,分别被B、C、D装置充分吸收;
(10)①装置B增加的质量为生成的水的质量,即102.7g-100.0g=2.7g,装置C增加的质量为生成的二氧化碳的质量,即104.4g-100.0g=4.4g;氢元素和碳元素质量以及原子个数守恒,因此y:z=$\frac{2.7g}{18}$×2:$\frac{4.4g}{44}$=3:1;根据氢元素质量守恒,样品中氢氧根的质量为2.7g×$\frac{2}{18}÷\frac{1}{17}$=5.1g;根据碳元素质量守恒,样品中碳酸根的质量为4.4g×$\frac{12}{44}÷\frac{12}{60}$=6g;因此铜元素的质量为27.1g-5.1g-6g=16g;因此样品中x:y:z=$\frac{16g}{64}$:$\frac{5.1g}{17}$:$\frac{6g}{60}$=5:6:2;故答案为:5:6:2;
②由①分析可知:氢氧根中氧的质量为5.1g-5.1g×$\frac{1}{17}$=4.8g,碳酸根中氧的质量为6.0g-6.0g×$\frac{12}{60}$=4.8g,装置D吸收氧气中氧元素质量为101.0g-100.0g=1.0g,水中氧元素的质量为2.7g×$\frac{16}{18}$=2.4g,二氧化碳中的氧元素质量为4.4g×$\frac{32}{44}$=3.2g,则剩余固体中氧元素质量为4.8g+4.8g-1.0g-2.4g-3.2g=3g,最后装置A剩余固体中铜、氧元素质量比为16g:3g=16:3。故答案为:16:3。
②《吕氏春秋•别类篇》载有“金(铜)柔锡柔,合两柔则刚”,表明青铜的硬度比纯铜大;故答案为:大;
(2)2022年6月17日,我国第三艘航母下水命名。航母的飞行甲板,既能承受舰载机起降时产生的强烈冲击和摩擦,也能承受舰载机的尾焰炙烤,还能遭受潮湿盐雾的海洋大气环境侵蚀。由此可推知,制造飞行甲板的材料具有的性质是:耐高温;耐腐蚀;硬度大,故选:ACD;
(3)①探究铁锈蚀的实验中,试管C中的铁钉同时与水和氧气接触,所以最易生锈。通过对比试管A、C中的现象,可以得出铁生锈需要与水接触。故答案为:C;水;
②铁合金是目前世界上应用最广泛的金属材料。为防止铁制品生锈,通常采取的具体措施:涂漆、涂油、制成合金、镀一层金属等。故答案为:涂漆、涂油、制成合金、镀一层金属等;
③铝与氧气反应生成氧化铝,化学方程式:4Al+3O2=2Al2O3。故答案为:4Al+3O2=2Al2O3;
(4)①磁铁矿的主要成分是Fe3O4,则硬质玻璃管中发生主要反应的化学方程式是:Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2。故答案为:Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2;
②由于CO有毒,污染空气,所以C装置的作用是处理尾气。故答案为:处理尾气;
③甲装置是为了防倒吸的,则乙装置的作用是吸收二氧化碳、收集一氧化碳。故答案为:吸收二氧化碳、收集一氧化碳;
(5)①孔雀石需要粉碎,这样做的目的是扩大反应接触面积。加入的稀硫酸需过量的目的是使孔雀石反应完全。故答案为:扩大反应接触面积;使孔雀石反应完全;
②步骤b中发生反应是铁与硫酸铜反应置换出铜,化学方程式 Fe+CuSO4═FeSO4+Cu,所以固体B的成分铁粉和铜。故答案为:Fe+CuSO4═FeSO4+Cu;铁粉和铜;
(6)根据铜锈的主要成分可用Cux(OH)y(CO3)z化学式可知,除了铜元素外,还含有C、H、O元素,故可推测铜生锈很可能与空气中的氧气、二氧化碳和水有关。判断铜锈的产生需要CO2参加,则说明实验的变量是二氧化碳,故对比实验为:甲丁;故答案为:水;甲丁;
实验步骤:①有气体参加的反应,实验装置连接好后先要检查装置的气密性;故答案为:检验装置的气密性;
(7)步骤①中的操作是检验装置的气密性,方法是:对A装置加热,如果B、C、E装置内的导管都冒出气泡,停止加热后,B、C、E装置内长的导管形成一段水柱,说明装置气密性良好。故答案为:对A装置加热,如果B、C、E装置内的导管都冒出气泡,停止加热后,B、C、E装置内长的导管形成一段水柱,说明装置气密性良好;
(8)铜和氧气加热生成黑色氧化铜,D装置中的实验现象是红色固体变为黑色;故答案为:红色固体变为黑色;
(9)停止加热后仍需继续通N2,为了使测定结果更准确,因此应将生成的水、二氧化碳和氧气全部赶到后面的装置中,分别被B、C、D装置充分吸收;因此停止加热后仍需继续通N2,除可防止倒吸,还能使生成的水、二氧化碳和氧气分别被B、C、D装置充分吸收。故答案为:将生成的水、二氧化碳和氧气全部赶到后面的装置中,分别被B、C、D装置充分吸收;
(10)①装置B增加的质量为生成的水的质量,即102.7g-100.0g=2.7g,装置C增加的质量为生成的二氧化碳的质量,即104.4g-100.0g=4.4g;氢元素和碳元素质量以及原子个数守恒,因此y:z=$\frac{2.7g}{18}$×2:$\frac{4.4g}{44}$=3:1;根据氢元素质量守恒,样品中氢氧根的质量为2.7g×$\frac{2}{18}÷\frac{1}{17}$=5.1g;根据碳元素质量守恒,样品中碳酸根的质量为4.4g×$\frac{12}{44}÷\frac{12}{60}$=6g;因此铜元素的质量为27.1g-5.1g-6g=16g;因此样品中x:y:z=$\frac{16g}{64}$:$\frac{5.1g}{17}$:$\frac{6g}{60}$=5:6:2;故答案为:5:6:2;
②由①分析可知:氢氧根中氧的质量为5.1g-5.1g×$\frac{1}{17}$=4.8g,碳酸根中氧的质量为6.0g-6.0g×$\frac{12}{60}$=4.8g,装置D吸收氧气中氧元素质量为101.0g-100.0g=1.0g,水中氧元素的质量为2.7g×$\frac{16}{18}$=2.4g,二氧化碳中的氧元素质量为4.4g×$\frac{32}{44}$=3.2g,则剩余固体中氧元素质量为4.8g+4.8g-1.0g-2.4g-3.2g=3g,最后装置A剩余固体中铜、氧元素质量比为16g:3g=16:3。故答案为:16:3。