液相自催化反应A==B的速率程为-(r)_(A)=-dfrac (d{C)_(A)}(dt)=k(C)_(A)(C)_(B)mol/(L·h),在等温间歇釜中测定反应速率,CA0=0.95mol/L,CB0=0.05mol/L,经过1小时后可测得反应速率最大值,求该温度下的反应速率常数k。
液相自催化反应A==B的速率程为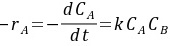 mol/(L·h),在等温间歇釜中测定反应速率,CA0=0.95mol/L,CB0=0.05mol/L,经过1小时后可测得反应速率最大值,求该温度下的反应速率常数k。
mol/(L·h),在等温间歇釜中测定反应速率,CA0=0.95mol/L,CB0=0.05mol/L,经过1小时后可测得反应速率最大值,求该温度下的反应速率常数k。
题目解答
答案
解:CB=CA0+CB0-CA=1-CA 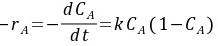
反应速率最大时: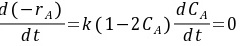 ,得到CA=0.5 mol/L
,得到CA=0.5 mol/L
对反应速率式积分得到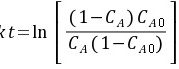 ,代入数据得到k=2.944 L/(mol·h)
,代入数据得到k=2.944 L/(mol·h)
解析
考查要点:本题主要考查化学反应动力学中自催化反应的速率方程处理及积分方法,重点在于利用速率最大值条件确定关键浓度,并结合初始条件求解速率常数。
解题核心思路:
- 浓度关系简化:利用反应的物料平衡关系,将CB表示为CA的函数,简化速率方程。
- 速率最大值条件:通过分析速率方程的极值点,确定速率最大时的CA值。
- 微分方程积分:对速率方程分离变量并积分,结合已知条件求解速率常数k。
破题关键点:
- CB与CA的关系:通过物料守恒推导CB = 1 - CA,简化速率方程。
- 速率最大值条件:二次函数极值点公式或导数法确定CA = 0.5 mol/L。
- 积分处理:正确应用部分分式分解积分,代入初始条件和极值条件求解k。
步骤1:建立浓度关系
根据反应A→B的物料守恒,总浓度守恒为:
$C_A + C_B = C_{A0} + C_{B0} = 0.95 + 0.05 = 1 \, \text{mol/L}$
因此,$C_B = 1 - C_A$。
步骤2:速率方程简化
将$C_B = 1 - C_A$代入速率方程:
$-\frac{dC_A}{dt} = k C_A (1 - C_A)$
步骤3:确定速率最大值条件
速率$r_A = k C_A (1 - C_A)$为二次函数,其最大值出现在顶点处:
$C_A = \frac{-b}{2a} = \frac{1}{2} \, \text{mol/L}$
步骤4:积分速率方程
分离变量并积分:
$\int \frac{1}{C_A (1 - C_A)} dC_A = -k \int dt$
部分分式分解得:
$\int \left( \frac{1}{C_A} + \frac{1}{1 - C_A} \right) dC_A = -k t + \ln \frac{C_{A0}}{1 - C_{A0}}$
积分结果为:
$\ln \frac{C_A}{1 - C_A} = -k t + \ln 19$
步骤5:代入极值条件求k
当$t = 1$小时,$C_A = 0.5$ mol/L时:
$\ln \frac{0.5}{1 - 0.5} = -k \cdot 1 + \ln 19 \implies 0 = -k + \ln 19$
解得:
$k = \ln 19 \approx 2.944 \, \text{L/(mol·h)}$