题目
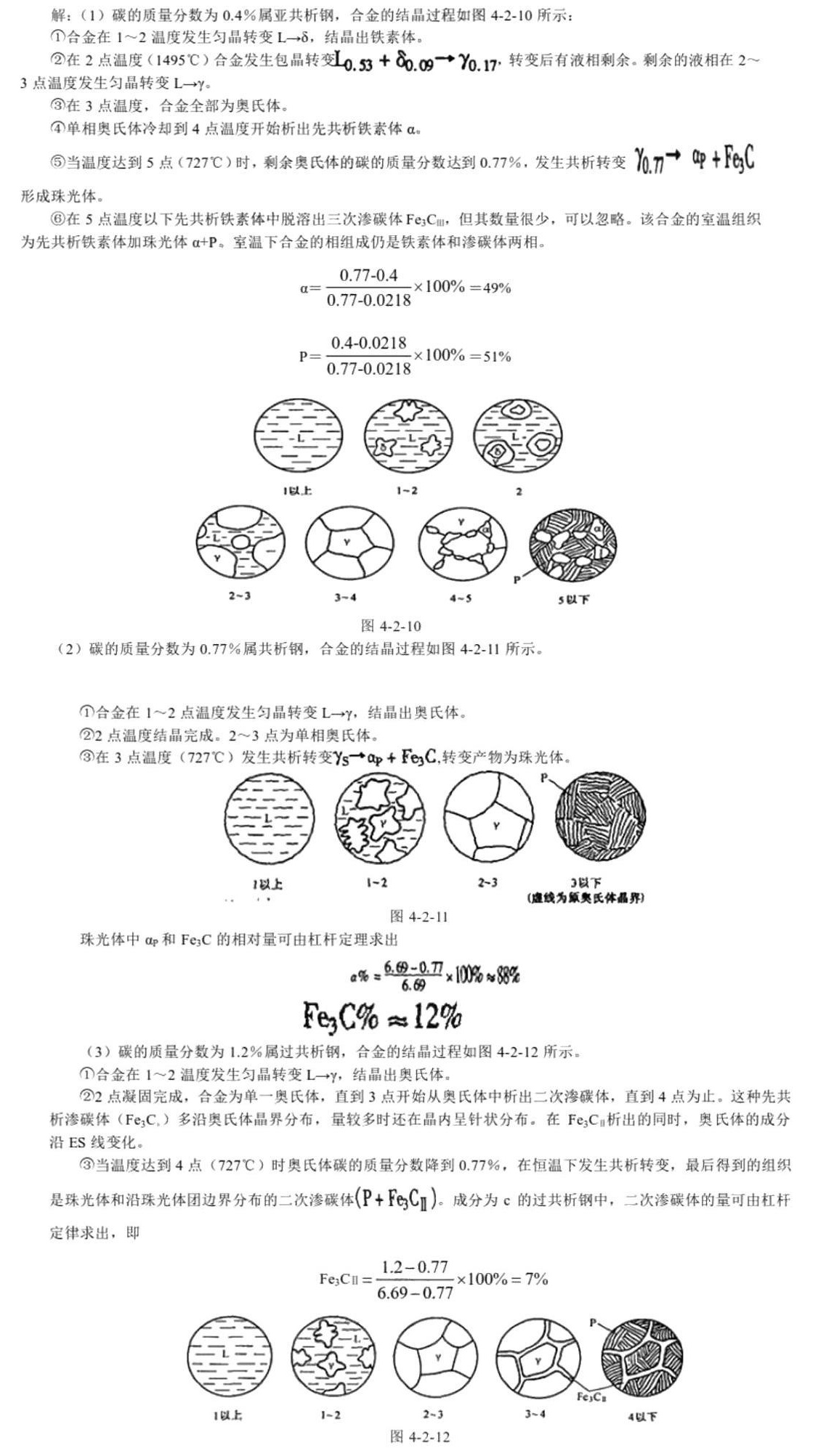
14.分析碳的质量分数为0.4%、0.77%、1.2%的碳钢从液态冷至室温时的结晶过程。画出结晶过程示意图,-|||-计算室温下三种钢组成相的相对量和组织组成体的相对量。

题目解答
答案
解析
步骤 1:碳的质量分数为0.4%的碳钢结晶过程
- 该合金属于亚共析钢,结晶过程如下:
- 从液态冷却到4点温度开始析出先共析铁素体α。
- 当温度达到5点(727℃)时,剩余奥氏体的碳的质量分数达到0.77%,发生共析转变形成珠光体。
- 在5点温度以下先共析铁素体中脱溶出三次渗碳体Fe3Cm,但其数量很少,可以忽略。
- 室温组织为先共析铁素体加珠光体α+P。
步骤 2:碳的质量分数为0.77%的碳钢结晶过程
- 该合金属于共析钢,结晶过程如下:
- 合金在1~2点温度发生匀晶转变L→γ,结晶出奥氏体。
- 2点温度结晶完成,2~3点为单相奥氏体。
- 在3点温度(727℃)发生共析转变γ→α+Fe3C,变变产物为珠光体。
步骤 3:碳的质量分数为1.2%的碳钢结晶过程
- 该合金属于过共析钢,结晶过程如下:
- 合金在1~2温度发生匀晶转变L→γ,结晶出奥氏体。
- 2点凝固完成,合金为单一奥氏体,直到3点开始从奥氏体中析出二次渗碳体,直到4点为止。
- 这种先共析渗碳体(Fe3C)多沿奥氏体晶界分布,量较多时还在晶内呈针状分布。
- 在Fe3C析出的同时,奥氏体的成分沿ES线变化。
- 当温度达到4点(727℃)时奥氏体碳的质量分数降到0.77%,在恒温下发生共析转变,最后得到的组织是珠光体和沿珠光体团边界分布的二次渗碳体Fe3C。
步骤 4:计算室温下三种钢组成相的相对量和组织组成体的相对量
- 碳的质量分数为0.4%的碳钢:
- 铁素体α的相对量:$a=\dfrac {0.77-0.4}{0.77-0.0218}\times 100\% =49\%$
- 珠光体P的相对量:$P=\dfrac {0.4-0.0218}{0.77-0.0218}\times 100\% =51\%$
- 碳的质量分数为0.77%的碳钢:
- 珠光体P中α和Fe3C的相对量:$P_{\alpha}=\dfrac {0.77-0.0218}{6.69-0.0218}\times 100\% =11\%$,$P_{Fe3C}=\dfrac {6.69-0.77}{6.69-0.0218}\times 100\% =89\%$
- 碳的质量分数为1.2%的碳钢:
- 二次渗碳体Fe3C的相对量:$Fe3C_{II}=\dfrac {1.2-0.77}{6.69-0.77}\times 100\% =7\%$
- 该合金属于亚共析钢,结晶过程如下:
- 从液态冷却到4点温度开始析出先共析铁素体α。
- 当温度达到5点(727℃)时,剩余奥氏体的碳的质量分数达到0.77%,发生共析转变形成珠光体。
- 在5点温度以下先共析铁素体中脱溶出三次渗碳体Fe3Cm,但其数量很少,可以忽略。
- 室温组织为先共析铁素体加珠光体α+P。
步骤 2:碳的质量分数为0.77%的碳钢结晶过程
- 该合金属于共析钢,结晶过程如下:
- 合金在1~2点温度发生匀晶转变L→γ,结晶出奥氏体。
- 2点温度结晶完成,2~3点为单相奥氏体。
- 在3点温度(727℃)发生共析转变γ→α+Fe3C,变变产物为珠光体。
步骤 3:碳的质量分数为1.2%的碳钢结晶过程
- 该合金属于过共析钢,结晶过程如下:
- 合金在1~2温度发生匀晶转变L→γ,结晶出奥氏体。
- 2点凝固完成,合金为单一奥氏体,直到3点开始从奥氏体中析出二次渗碳体,直到4点为止。
- 这种先共析渗碳体(Fe3C)多沿奥氏体晶界分布,量较多时还在晶内呈针状分布。
- 在Fe3C析出的同时,奥氏体的成分沿ES线变化。
- 当温度达到4点(727℃)时奥氏体碳的质量分数降到0.77%,在恒温下发生共析转变,最后得到的组织是珠光体和沿珠光体团边界分布的二次渗碳体Fe3C。
步骤 4:计算室温下三种钢组成相的相对量和组织组成体的相对量
- 碳的质量分数为0.4%的碳钢:
- 铁素体α的相对量:$a=\dfrac {0.77-0.4}{0.77-0.0218}\times 100\% =49\%$
- 珠光体P的相对量:$P=\dfrac {0.4-0.0218}{0.77-0.0218}\times 100\% =51\%$
- 碳的质量分数为0.77%的碳钢:
- 珠光体P中α和Fe3C的相对量:$P_{\alpha}=\dfrac {0.77-0.0218}{6.69-0.0218}\times 100\% =11\%$,$P_{Fe3C}=\dfrac {6.69-0.77}{6.69-0.0218}\times 100\% =89\%$
- 碳的质量分数为1.2%的碳钢:
- 二次渗碳体Fe3C的相对量:$Fe3C_{II}=\dfrac {1.2-0.77}{6.69-0.77}\times 100\% =7\%$