标准吉布斯自由能的应用(1) 判断反应进行的方向和限度吉布斯自由能的重要作用是作为反应自发性的判据,判断反应进行的方向和限度。可用于判断标准态时反应的方向。<0 标准态时反应能自发进行; =0 标准态时反应处于平衡状态; >0 标准态时反应不能自发进行。(2) 估算反应自发进行的温度若忽略温度对和的影响,就可用298.15K时的标准热力学数据近似地估算焓减熵减或焓增熵增类化学反应进行时的温度条件。如果温度对反应方向有影响,即温度的高低决定的正负时,必然有一温度T值与 (T)=0相对应,则此温度称为转变温度T转。 (T)≈ (298.15K)–T转(298.15K)=0T转= (298.15K)/ (298.15K) (3-20)例3-11 已知在标准状态下有关物质的热力学数据,试判断下列反应在298K时能否自发进行,并估算反应自发进行的温度条件。6Fe2O3(s) = 4Fe3O4(s)+O2 (g) / (kJ·mol-1) –824 –1118 0/ (J·mol-1·K-1) 87.4 146 205
标准吉布斯自由能的应用
(1) 判断反应进行的方向和限度
吉布斯自由能的重要作用是作为反应自发性的判据,判断反应进行的方向和限度。可用于判断标准态时反应的方向。
<0 标准态时反应能自发进行;
=0 标准态时反应处于平衡状态;
>0 标准态时反应不能自发进行。
(2) 估算反应自发进行的温度
若忽略温度对和的影响,就可用298.15K时的标准热力学数据近似地估算焓减熵减或焓增熵增类化学反应进行时的温度条件。
如果温度对反应方向有影响,即温度的高低决定的正负时,必然有一温度T值与 (T)=0相对应,则此温度称为转变温度T转。
(T)≈ (298.15K)–T转(298.15K)=0
T转= (298.15K)/ (298.15K) (3-20)
例3-11 已知在标准状态下有关物质的热力学数据,试判断下列反应在298K时能否自发进行,并估算反应自发进行的温度条件。
6Fe2O3(s) = 4Fe3O4(s)+O2 (g)
/ (kJ·mol-1) –824 –1118 0
/ (J·mol-1·K-1) 87.4 146 205
题目解答
答案
解: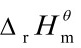 =4
=4 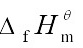 (Fe3O4,s)–6
(Fe3O4,s)–6 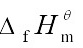 ( Fe2O3,s)
( Fe2O3,s)
=4×(–1118 kJ·mol-1)–6×(–824kJ·mol-1) = 472 kJ·mol-1
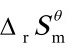 =[4
=[4 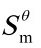 (Fe3O4,s)+
(Fe3O4,s)+ 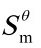 (O2,s)]–6
(O2,s)]–6 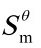 ( Fe2O3,s)
( Fe2O3,s)
= (4×146 J·mol-1·K-1+205 J·mol-1·K-1)–(6 ×87.4 J·mol-1·K-1) = 264.6J·mol-1·K-1
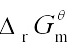 =
=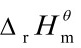 –T
–T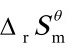 =472kJ·mol-1–298K ×264.6×10-3kJ·mol·K-1 = 393.1kJ·mol-1
=472kJ·mol-1–298K ×264.6×10-3kJ·mol·K-1 = 393.1kJ·mol-1
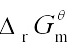 > 0,反应在标准态及298K时不能自发进行。
> 0,反应在标准态及298K时不能自发进行。
虽然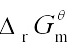 > 40kJ·mol-1时,浓度或压力条件的影响不会改变反应的方向,但根据反应属焓增熵增的特点,改变温度可使反应自发进行。
> 40kJ·mol-1时,浓度或压力条件的影响不会改变反应的方向,但根据反应属焓增熵增的特点,改变温度可使反应自发进行。
T转=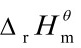 (298.15K)/
(298.15K)/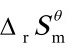 (298.15K)
(298.15K)
=(472 kJ·mol-1)/(264.6×10-3kJ·mol·K-1)=1784K
即在标准状态下,温度为1784K以上时,Fe2O3(s)可转化为Fe3O4(s)。
(3) 选择合理的合成方法
(4)判断物质的稳定性
另外,吉布斯自由能在化学平衡等许多方面都有重要作用。
3.4化学反应的限度––化学平衡
3.4.1 化学平衡
根据吉布斯自由能判据,当ΔrGm=0时,反应达最大限度,处于平衡状态。化学平衡的建立是以可逆反应为前提的。可逆反应是指在同一条件下既能正向进行又能逆向进行的反应。绝大多数化学反应都具有可逆性,都可在不同程度上达到平衡。
从动力学角度看,反应开始时,反应物浓度较大,产物浓度较小,所以正反应速率大于逆反应速率。随着反应的进行,反应物浓度不断减小,产物浓度不断增大,所以正反应速率不断减小,逆反应速率不断增大。当正、逆反应速率相等时,系统中各物质的浓度不再发生变化,反应达到了平衡。
化学平衡是动态平衡。
3.4.2 标准平衡常数K
解析
根据给定的热力学数据,计算反应的标准摩尔焓变(ΔrHmθ)。
步骤 2:计算反应的标准摩尔熵变
根据给定的热力学数据,计算反应的标准摩尔熵变(ΔrSmθ)。
步骤 3:计算反应的标准摩尔吉布斯自由能变
根据计算出的ΔrHmθ和ΔrSmθ,计算反应的标准摩尔吉布斯自由能变(ΔrGmθ)。
步骤 4:判断反应在298K时能否自发进行
根据ΔrGmθ的值,判断反应在298K时能否自发进行。
步骤 5:估算反应自发进行的温度条件
根据ΔrHmθ和ΔrSmθ,估算反应自发进行的温度条件。