题目
1.写出下列溶液的质子平衡方程:-|||-a.浓度为c1的NH3与浓度为c2的NH 4Cl的混合溶液;-|||-b.浓度为c1的N aOH与浓度为c 2的H3 BO3的混合溶液;-|||-c.浓度为c1的H 3PO4与浓度为c 2的HCOOH的混合溶液;-|||-d. .010molcdot (L)^-1Fe(Cl)_(3) 溶液。

题目解答
答案
1.a、b、c、d的质子平衡方程分别为:
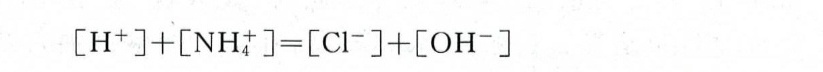
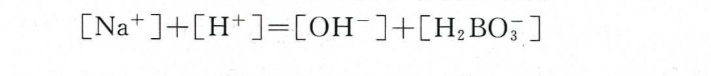
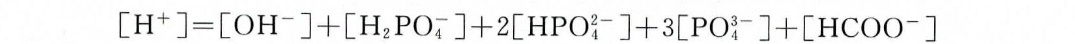
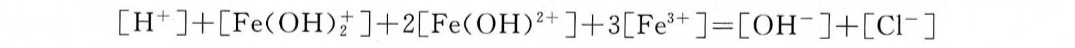
解析
质子平衡方程是溶液中所有物质的质子守恒关系,需结合电荷守恒和各物质的解离、水解情况推导。
- a:NH3(弱碱)与NH4Cl(强酸弱碱盐)混合,NH4+水解产H+,NH3水解产OH-,Cl-为旁观离子。
- b:NaOH(强碱)与H3BO3(弱酸)混合,Na+为旁观离子,H3BO3解离产H+和H2BO3^-。
- c:H3PO4(三元弱酸)与HCOOH(弱酸)混合,需考虑两酸多步解离产生的酸根。
- d:FeCl3(强酸性盐)水解生成多种Fe羟基物种,需全面考虑电荷平衡。
a. NH3与NH4Cl混合溶液
关键点:
- 电荷守恒:阳离子总电荷(NH4+、H+)= 阴离子总电荷(Cl-、OH-)。
- Cl-为旁观离子,不参与质子转移。
方程:
$[H^+] + [NH_4^+] = [Cl^-] + [OH^-]$
b. NaOH与H3BO3混合溶液
关键点:
- 电荷守恒:阳离子总电荷(Na+、H+)= 阴离子总电荷(OH-、H2BO3^-)。
- H3BO3第一步解离为主,生成H+和H2BO3^-。
方程:
$[Na^+] + [H^+] = [OH^-] + [H_2BO_3^-]$
c. H3PO4与HCOOH混合溶液
关键点:
- 电荷守恒:H+来自两酸解离,阴离子为OH-及各酸根(H2PO4^-、HPO4^2-、PO4^3-、HCOO^-)。
- 多元酸需逐级考虑酸根电荷。
方程:
$[H^+] = [OH^-] + [H_2PO_4^-] + 2[HPO_4^{2-}] + 3[PO_4^{3-}] + [HCOO^-]$
d. FeCl3溶液
关键点:
- Fe^3+水解生成多种羟基物种(如Fe(OH)+、Fe(OH)2^-、Fe(OH)3)。
- 电荷守恒:H+与Fe物种的总电荷 = Cl^-与OH-的总电荷。
方程:
$[H^+] + [Fe(OH)_2^+] + 3[Fe(OH)^{-}] = [Cl^-] + [OH^-]$