题目
1.将下列反应组成原电池(温度为298.15 K) (Fe)^3++Cu=!=!= 2(Fe)^2++(Cu)^2+-|||-varphi '((Cu)^2+/(Cu)^-)=0.342V (varphi )^theta ((Fe)^3+)(Fe)^2+)=0.771-|||-(1)计算原电池的标准电动势;(2)写出其电池符号;(3)指出正极、负极,并写-|||-出电极反应;(4)当 ^2+ 的浓度升到 cdot (L)^-1 时,原电池的电动势为多少?

题目解答
答案
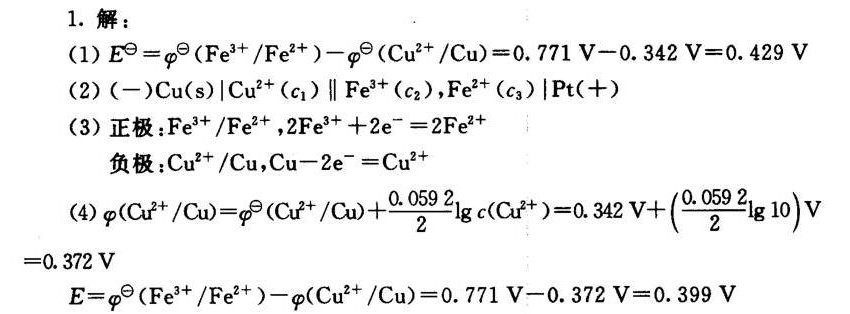
解析
步骤 1:计算原电池的标准电动势
原电池的标准电动势 $E^\theta$ 可以通过标准电极电位的差值来计算。根据给定的电极电位,${\varphi }^{\theta }({Fe}^{3+}/{Fe}^{2+})=0.771V$ 和 ${\varphi }^{\theta }({Cu}^{2+}/Cu)=0.342V$,标准电动势 $E^\theta$ 为:
$$E^\theta = {\varphi }^{\theta }({Fe}^{3+}/{Fe}^{2+}) - {\varphi }^{\theta }({Cu}^{2+}/Cu) = 0.771V - 0.342V = 0.429V$$
步骤 2:写出电池符号
电池符号表示了电池的组成,其中负极在左边,正极在右边。根据反应,负极是铜电极,正极是铁电极。电池符号为:
$$(-)Cu(s)|{Cu}^{2+}({C}_{1})||{Fe}^{3+}({C}_{2}),{Fe}^{2+}({C}_{3})|Pt(+)$$
步骤 3:指出正极、负极,并写出电极反应
正极是铁电极,电极反应为:
$$2{Fe}^{3+} + 2e^- \rightarrow 2{Fe}^{2+}$$
负极是铜电极,电极反应为:
$$Cu \rightarrow {Cu}^{2+} + 2e^-$$
步骤 4:计算当 ${Cu}^{2+}$ 的浓度升到 $10mol\cdot {L}^{-1}$ 时,原电池的电动势
根据能斯特方程,电动势 $E$ 可以通过标准电动势 $E^\theta$ 和反应物的浓度来计算。当 ${Cu}^{2+}$ 的浓度升到 $10mol\cdot {L}^{-1}$ 时,电动势 $E$ 为:
$$E = E^\theta - \frac{0.0592}{n} \log \frac{[Cu^{2+}]}{[Fe^{3+}]^2[Fe^{2+}]^2}$$
其中,$n$ 为电子转移数,$[Cu^{2+}]$ 为铜离子的浓度,$[Fe^{3+}]$ 和 $[Fe^{2+}]$ 分别为铁离子的浓度。由于题目中没有给出铁离子的浓度,我们假设它们的浓度为 $1mol\cdot {L}^{-1}$,则:
$$E = 0.429V - \frac{0.0592}{2} \log \frac{10}{1^2 \cdot 1^2} = 0.429V - 0.0592V = 0.370V$$
原电池的标准电动势 $E^\theta$ 可以通过标准电极电位的差值来计算。根据给定的电极电位,${\varphi }^{\theta }({Fe}^{3+}/{Fe}^{2+})=0.771V$ 和 ${\varphi }^{\theta }({Cu}^{2+}/Cu)=0.342V$,标准电动势 $E^\theta$ 为:
$$E^\theta = {\varphi }^{\theta }({Fe}^{3+}/{Fe}^{2+}) - {\varphi }^{\theta }({Cu}^{2+}/Cu) = 0.771V - 0.342V = 0.429V$$
步骤 2:写出电池符号
电池符号表示了电池的组成,其中负极在左边,正极在右边。根据反应,负极是铜电极,正极是铁电极。电池符号为:
$$(-)Cu(s)|{Cu}^{2+}({C}_{1})||{Fe}^{3+}({C}_{2}),{Fe}^{2+}({C}_{3})|Pt(+)$$
步骤 3:指出正极、负极,并写出电极反应
正极是铁电极,电极反应为:
$$2{Fe}^{3+} + 2e^- \rightarrow 2{Fe}^{2+}$$
负极是铜电极,电极反应为:
$$Cu \rightarrow {Cu}^{2+} + 2e^-$$
步骤 4:计算当 ${Cu}^{2+}$ 的浓度升到 $10mol\cdot {L}^{-1}$ 时,原电池的电动势
根据能斯特方程,电动势 $E$ 可以通过标准电动势 $E^\theta$ 和反应物的浓度来计算。当 ${Cu}^{2+}$ 的浓度升到 $10mol\cdot {L}^{-1}$ 时,电动势 $E$ 为:
$$E = E^\theta - \frac{0.0592}{n} \log \frac{[Cu^{2+}]}{[Fe^{3+}]^2[Fe^{2+}]^2}$$
其中,$n$ 为电子转移数,$[Cu^{2+}]$ 为铜离子的浓度,$[Fe^{3+}]$ 和 $[Fe^{2+}]$ 分别为铁离子的浓度。由于题目中没有给出铁离子的浓度,我们假设它们的浓度为 $1mol\cdot {L}^{-1}$,则:
$$E = 0.429V - \frac{0.0592}{2} \log \frac{10}{1^2 \cdot 1^2} = 0.429V - 0.0592V = 0.370V$$