题目
2.13 某酸HA的 _(a)^theta =8.4times (10)^-4 .10molcdot (L)^-1 此酸的 ((H)^+) 浓度为-|||-()-|||-a. .2times (10)^-3molcdot (L)^-1 b. https:/img.zuoyebang.cc/zyb_e064486c9bc283f85c954acc72c4d749.jpg.8times (10)^-2molcdot (L)^-1-|||-c. .9times (10)^-3molcdot (L)^-1 d. .8times (10)^-3molcdot (L)^-1
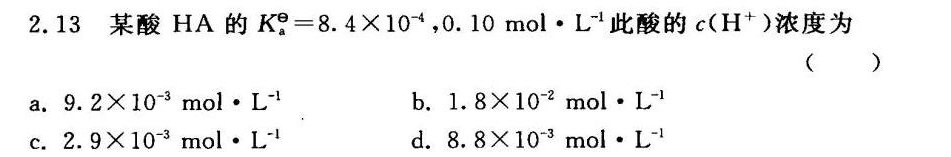
题目解答
答案
解析
步骤 1:确定酸的解离方程式
酸HA的解离方程式为:$HA \rightleftharpoons H^{+} + A^{-}$
步骤 2:写出酸的解离常数表达式
酸的解离常数${K}_{a}^{\theta }$的表达式为:${K}_{a}^{\theta } = \frac{[H^{+}][A^{-}]}{[HA]}$
步骤 3:设解离出的$H^{+}$浓度为$x$
由于$HA$的初始浓度为$0.10mol\cdot {L}^{-1}$,解离出的$H^{+}$和$A^{-}$的浓度相等,设为$x$,则$[HA]$的浓度为$0.10-x$。由于$x$相对于$0.10$很小,可以近似认为$0.10-x \approx 0.10$。
步骤 4:代入${K}_{a}^{\theta }$的值,求解$x$
将${K}_{a}^{\theta }=8.4\times {10}^{-4}$代入${K}_{a}^{\theta } = \frac{x^2}{0.10}$,解得$x = \sqrt{8.4\times {10}^{-4} \times 0.10} = 9.2\times {10}^{-3}mol\cdot {L}^{-1}$
酸HA的解离方程式为:$HA \rightleftharpoons H^{+} + A^{-}$
步骤 2:写出酸的解离常数表达式
酸的解离常数${K}_{a}^{\theta }$的表达式为:${K}_{a}^{\theta } = \frac{[H^{+}][A^{-}]}{[HA]}$
步骤 3:设解离出的$H^{+}$浓度为$x$
由于$HA$的初始浓度为$0.10mol\cdot {L}^{-1}$,解离出的$H^{+}$和$A^{-}$的浓度相等,设为$x$,则$[HA]$的浓度为$0.10-x$。由于$x$相对于$0.10$很小,可以近似认为$0.10-x \approx 0.10$。
步骤 4:代入${K}_{a}^{\theta }$的值,求解$x$
将${K}_{a}^{\theta }=8.4\times {10}^{-4}$代入${K}_{a}^{\theta } = \frac{x^2}{0.10}$,解得$x = \sqrt{8.4\times {10}^{-4} \times 0.10} = 9.2\times {10}^{-3}mol\cdot {L}^{-1}$