毒扁豆碱为二元碱,试计算0.01mol·L-1毒扁豆碱溶液的pH值。已知Kb1 = 7.6×10-7,Kb2 = 5.8×10-13。.
毒扁豆碱为二元碱,试计算0.01mol·L-1毒扁豆碱溶液的pH值。已知Kb1 = 7.6×10-7,Kb2 = 5.8×10-13。
.题目解答
答案
解 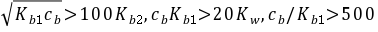
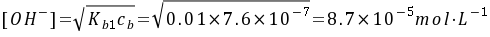 ,pH=9.94
,pH=9.94
[9.94]
.解析
考查要点:本题主要考查二元弱碱溶液pH值的计算,需判断多步解离中的主要贡献步骤,并应用近似公式简化计算。
解题核心思路:
- 判断二元碱两步解离的相对贡献:通过比较第一步解离产生的OH⁻浓度与第二步解离的Kb2,确定是否忽略第二步解离。
- 验证近似条件:确认是否满足使用平方根公式($\sqrt{K_b C}$)的条件,即解离度足够小。
- 简化计算:仅考虑第一步解离,计算OH⁻浓度并最终求出pH。
破题关键点:
- 比较$\sqrt{K_{b1}C}$与$100K_{b2}$:若前者远大于后者,说明第二步解离可忽略。
- 验证$C K_{b1} > 20K_w$:确保水的自解离可忽略。
- 验证$\frac{C}{K_{b1}} > 500$:确保解离度小,可用平方根公式。
步骤1:判断第二步解离是否可忽略
计算$\sqrt{K_{b1}C}$与$100K_{b2}$:
$\sqrt{K_{b1}C} = \sqrt{0.01 \times 7.6 \times 10^{-7}} = 8.7 \times 10^{-5} \, \text{mol·L}^{-1}, \\
100K_{b2} = 100 \times 5.8 \times 10^{-13} = 5.8 \times 10^{-11} \, \text{mol·L}^{-1}.$
因$8.7 \times 10^{-5} \gg 5.8 \times 10^{-11}$,第二步解离对OH⁻浓度的贡献可忽略。
步骤2:验证近似条件
-
水的自解离可忽略:
$C K_{b1} = 0.01 \times 7.6 \times 10^{-7} = 7.6 \times 10^{-9}$,
$20K_w = 20 \times 10^{-14} = 2 \times 10^{-15}$,
显然$7.6 \times 10^{-9} \gg 2 \times 10^{-15}$,满足条件。 -
解离度小:
$\frac{C}{K_{b1}} = \frac{0.01}{7.6 \times 10^{-7}} \approx 13158 \gg 500$,可用平方根公式。
步骤3:计算OH⁻浓度
仅考虑第一步解离,OH⁻浓度为:
$[OH^-] = \sqrt{K_{b1}C} = \sqrt{0.01 \times 7.6 \times 10^{-7}} = 8.7 \times 10^{-5} \, \text{mol·L}^{-1}.$
步骤4:计算pH值
$pOH = -\log(8.7 \times 10^{-5}) \approx 4.06, \\ pH = 14 - pOH = 9.94.$