(10分)物质生产工艺的设计,必须牢牢抓住物质的性质,而推断化合物的化学性质,常从两个角度分析:Ⅰ、物质的属类(如氧化物、酸、碱或盐等);Ⅱ、组成元素的化合价(是否处于最高价、中间价态或最低价)。请回答2(1)已知SiO2是一种难溶于水的酸性氧化物,试写出一个化学方程式表示该物质具有的化学性质:__________________________________;(2)已知,黄铜矿冶炼铜产生的炉渣含有Fe2O3、FeO、SiO2、Al2O3等多种氧化物,工业生产过程中可利用该炉渣制备Fe2O3。利用炉渣制备氧化铁的生产流程示意图如下:炉渣 s过滤→滤液氧化处理 NaOH溶液-|||-FaON溶液 洗涤沉淀-级烧氧化铁①若盐酸浸泡后所得滤液用氯气处理,反应的离子方程式为______________________;经“足量的NaOH溶液”处理后,存在于炉渣中的铝元素最终以_____________形式被除去。A.l B.Al(OH)3 C.Al3+ D.[Al(OH)4]—②现有a、稀硫酸 b、HNO3溶液 c、KSCN溶液 d、KMnO4溶液 e、NaOH溶液 f、碘水等试剂,为检验原炉渣中是否含有FeO,应该选择上述试剂中的_________________(填试剂对应的字母)。若存在FeO,将观察到的现象是________________________。炉渣 s过滤→滤液氧化处理 NaOH溶液-|||-FaON溶液 洗涤沉淀-级烧氧化铁A.莽草酸的分子式为C7H4O5B.莽草酸的分子之间不能发生酯化反应C.1mol莽草酸能与4mol Na反应D.莽草酸不能使溴水褪色14.可以用分液漏斗分离的一组液体混合物是( )A.溴和四氯化碳 B.苯和硝基苯 C.汽油和苯 D.硝基苯和水15.在测定中和热的实验中,下列说法正确的是A.使用环形玻璃棒是为了加快反应速率,减小实验误差B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触C.用0.5 mol·L−1 NaOH溶液分别与0.5 mol·L−1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同D.在测定中和热实验中需要使用的仪器有天平、量筒、烧杯、滴定管、温度计、环形玻璃搅拌棒16.关于化学反应的下列说法中正确的是( )A.分子的种类和数目一定发生改变B.原子的种类和数目一定发生改变C.能量变化主要是由化学键变化引起的D.能量变化的大小与反应物的质量多少无关17.下列离子中半径最大的是( )A.Na+ B.Mg2+ C.O2- D.F-18.可逆反应2NO2炉渣 s过滤→滤液氧化处理 NaOH溶液-|||-FaON溶液 洗涤沉淀-级烧氧化铁2NO+O2在容积固定的密闭容器中反应,达到平衡状态的标志是A.单位时间内生成n mol O2的同时生成2n mol NOB.用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态C.混合气体的颜色不再改变的状态D.混合气体的总质量不再改变的状态19.(6分)甲、乙两烧杯中各盛有100 mL 6 mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1:2,则加入铝粉的质量为A.10.8gB.7.2gC.5.4gD.3.6g20.(6分)砹是原子序数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是①砹易溶于某些有机溶剂;②砹单质与水反应,使砹全部转化成氢砹酸和次砹酸;③砹是黑色固体;④砹化银难溶于水; ⑤砹化氢很稳定。.
(10分)物质生产工艺的设计,必须牢牢抓住物质的性质,而推断化合物的化学性质,常从两个角度分析:Ⅰ、物质的属类(如氧化物、酸、碱或盐等);Ⅱ、组成元素的化合价(是否处于最高价、中间价态或最低价)。请回答2
(1)已知SiO2是一种难溶于水的酸性氧化物,试写出一个化学方程式表示该物质具有的化学性质:__________________________________;
(2)已知,黄铜矿冶炼铜产生的炉渣含有Fe2O3、FeO、SiO2、Al2O3等多种氧化物,工业生产过程中可利用该炉渣制备Fe2O3。利用炉渣制备氧化铁的生产流程示意图如下:

①若盐酸浸泡后所得滤液用氯气处理,反应的离子方程式为______________________;经“足量的NaOH溶液”处理后,存在于炉渣中的铝元素最终以_____________形式被除去。
A.l B.Al(OH)3 C.Al3+ D.[Al(OH)4]—
②现有a、稀硫酸 b、HNO3溶液 c、KSCN溶液 d、KMnO4溶液 e、NaOH溶液 f、碘水等试剂,为检验原炉渣中是否含有FeO,应该选择上述试剂中的_________________(填试剂对应的字母)。若存在FeO,将观察到的现象是________________________。
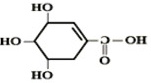
A.莽草酸的分子式为C7H4O5
B.莽草酸的分子之间不能发生酯化反应
C.1mol莽草酸能与4mol Na反应
D.莽草酸不能使溴水褪色
14.可以用分液漏斗分离的一组液体混合物是( )
A.溴和四氯化碳 B.苯和硝基苯 C.汽油和苯 D.硝基苯和水
15.在测定中和热的实验中,下列说法正确的是
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5 mol·L−1 NaOH溶液分别与0.5 mol·L−1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有天平、量筒、烧杯、滴定管、温度计、环形玻璃搅拌棒
16.关于化学反应的下列说法中正确的是( )
A.分子的种类和数目一定发生改变
B.原子的种类和数目一定发生改变
C.能量变化主要是由化学键变化引起的
D.能量变化的大小与反应物的质量多少无关
17.下列离子中半径最大的是( )
A.Na+ B.Mg2+ C.O2- D.F-
18.可逆反应2NO2 2NO+O2在容积固定的密闭容器中反应,达到平衡状态的标志是
2NO+O2在容积固定的密闭容器中反应,达到平衡状态的标志是
A.单位时间内生成n mol O2的同时生成2n mol NO
B.用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
C.混合气体的颜色不再改变的状态
D.混合气体的总质量不再改变的状态
19.(6分)甲、乙两烧杯中各盛有100 mL 6 mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1:2,则加入铝粉的质量为
A.10.8gB.7.2gC.5.4gD.3.6g
20.(6分)砹是原子序数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是
①砹易溶于某些有机溶剂;②砹单质与水反应,使砹全部转化成氢砹酸和次砹酸;③砹是黑色固体;④砹化银难溶于水; ⑤砹化氢很稳定。
.题目解答
答案
SiO2+2NaOH=Na2SiO3+H2O2Fe2++Cl2=Fe3++2Cl—Da、d高锰酸盐颜色褪去
.解析
考查要点:本题主要考查酸性氧化物的性质、Fe²⁺的氧化反应、铝元素的处理形式以及FeO的检验方法。
解题思路:
- 酸性氧化物性质:SiO₂作为酸性氧化物,能与强碱反应生成盐和水。
- Fe²⁺的氧化:盐酸浸泡后滤液中的Fe²⁺被Cl₂氧化为Fe³⁺,需写出对应的离子方程式。
- 铝元素的处理:过量NaOH溶液使Al³⁺转化为可溶的[Al(OH)₄]⁻,通过洗涤去除。
- FeO的检验:FeO中的Fe²⁺具有还原性,可用酸化后的KMnO₄溶液检验是否被氧化。
第(1)题
关键点:酸性氧化物SiO₂与强碱反应。
解答:SiO₂与NaOH反应生成Na₂SiO₃和H₂O,化学方程式为:
$\text{SiO}_2 + 2\text{NaOH} \rightarrow \text{Na}_2\text{SiO}_3 + \text{H}_2\text{O}$
第(2)题
①
关键点:Fe²⁺被Cl₂氧化,铝元素的最终形式。
解答:
- 离子方程式:Cl₂将Fe²⁺氧化为Fe³⁺,反应为:
$2\text{Fe}^{2+} + \text{Cl}_2 \rightarrow 2\text{Fe}^{3+} + 2\text{Cl}^-$ - 铝元素的处理:NaOH溶液使Al³⁺转化为[Al(OH)₄]⁻,通过洗涤去除,故选D。
②
关键点:FeO中Fe²⁺的还原性检验。
解答:
- 试剂选择:需用稀硫酸酸化后,加入KMnO₄溶液。若FeO存在,Fe²⁺被氧化,使KMnO₄褪色。
- 现象:紫色褪去。
答案:选a、d(稀硫酸和KMnO₄溶液)。