题目
按分子轨道理论写出NF,NF+,NF-基态时的电子组态,说明它们的不成对电子数和磁性(提示:按类似O2的能级排)。
按分子轨道理论写出NF,NF+,NF-基态时的电子组态,说明它们的不成对电子数和磁性(提示:按类似O2的能级排)。
题目解答
答案
解析
步骤 1:确定NF,NF^{+},NF^{-}的电子数
NF分子由一个氮原子和一个氟原子组成,氮原子有7个电子,氟原子有9个电子,所以NF分子共有16个电子。NF^{+}比NF少一个电子,所以有15个电子。NF^{-}比NF多一个电子,所以有17个电子。
步骤 2:确定分子轨道的能级顺序
根据提示,NF,NF^{+},NF^{-}的能级顺序与O_2类似,即1σ < 2σ < 1π < 3σ < 2π。
步骤 3:根据能级顺序和电子数,写出电子组态
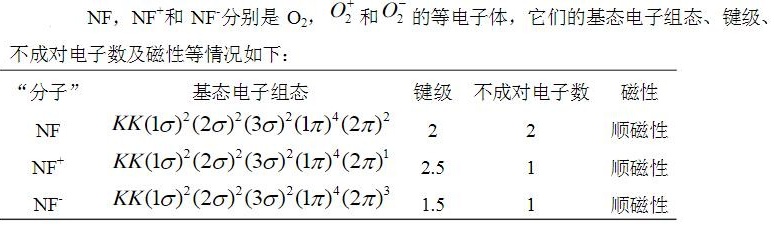
- NF分子有16个电子,根据能级顺序,电子组态为:${(1\sigma)}^{2}{(2\sigma)}^{2}{(3\sigma)}^{2}{(1\pi)}^{4}{(2\pi)}^{2}$。
- NF^{+}分子有15个电子,根据能级顺序,电子组态为:${(1\sigma)}^{2}{(2\sigma)}^{2}{(3\sigma)}^{2}{(1\pi)}^{4}{(2\pi)}^{1}$。
- NF^{-}分子有17个电子,根据能级顺序,电子组态为:${(1\sigma)}^{2}{(2\sigma)}^{2}{(3\sigma)}^{2}{(1\pi)}^{4}{(2\pi)}^{3}$。
步骤 4:确定不成对电子数和磁性
- NF分子的2π轨道上有2个电子,所以有2个不成对电子,是顺磁性的。
- NF^{+}分子的2π轨道上有1个电子,所以有1个不成对电子,是顺磁性的。
- NF^{-}分子的2π轨道上有3个电子,所以有1个不成对电子,是顺磁性的。
NF分子由一个氮原子和一个氟原子组成,氮原子有7个电子,氟原子有9个电子,所以NF分子共有16个电子。NF^{+}比NF少一个电子,所以有15个电子。NF^{-}比NF多一个电子,所以有17个电子。
步骤 2:确定分子轨道的能级顺序
根据提示,NF,NF^{+},NF^{-}的能级顺序与O_2类似,即1σ < 2σ < 1π < 3σ < 2π。
步骤 3:根据能级顺序和电子数,写出电子组态
- NF分子有16个电子,根据能级顺序,电子组态为:${(1\sigma)}^{2}{(2\sigma)}^{2}{(3\sigma)}^{2}{(1\pi)}^{4}{(2\pi)}^{2}$。
- NF^{+}分子有15个电子,根据能级顺序,电子组态为:${(1\sigma)}^{2}{(2\sigma)}^{2}{(3\sigma)}^{2}{(1\pi)}^{4}{(2\pi)}^{1}$。
- NF^{-}分子有17个电子,根据能级顺序,电子组态为:${(1\sigma)}^{2}{(2\sigma)}^{2}{(3\sigma)}^{2}{(1\pi)}^{4}{(2\pi)}^{3}$。
步骤 4:确定不成对电子数和磁性
- NF分子的2π轨道上有2个电子,所以有2个不成对电子,是顺磁性的。
- NF^{+}分子的2π轨道上有1个电子,所以有1个不成对电子,是顺磁性的。
- NF^{-}分子的2π轨道上有3个电子,所以有1个不成对电子,是顺磁性的。