题目
10 分 298K时,在Ag+/Ag电极中加入过量I,设达到平衡时[I] = 0.10 mol·dm-3,而另一个电极为Cu2+/Cu,[Cu2+] = 0.010 mol·dm-3,现将两电极组成原电池,写出原电池的符号、电池反应式、并计算电池反应的平衡常数。 (Ag+/Ag) = 0.80 V, (Cu2+/Cu) = 0.34 V,Ksp(AgI) = 1.0 10-18
10 分 298K时,在Ag+/Ag电极中加入过量I,设达到平衡时[I] = 0.10 mol·dm-3,而另一个电极为Cu2+/Cu,[Cu2+] = 0.010 mol·dm-3,现将两电极组成原电池,写出原电池的符号、电池反应式、并计算电池反应的平衡常数。
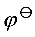 (Ag+/Ag) = 0.80 V,
(Ag+/Ag) = 0.80 V,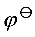 (Cu2+/Cu) = 0.34 V,Ksp(AgI) = 1.0 10-18
(Cu2+/Cu) = 0.34 V,Ksp(AgI) = 1.0 10-18题目解答
答案
10 分
(Cu2+/Cu) = 0.34 + (0.0591/2) lg(0.010) = 0.28 (V)
(AgI/Ag) = 0.80 + (0.0591/1) lg(Ksp / [I])
= 0.80 + 0.0591 lg(1.0 10-18/ 0.10) = -0.20 (V)
所以原电池符号:
Ag, AgI(s)│I(0.10 mol•dm-3)‖Cu2+(0.010 mol•dm-3)│Cu(s)
电池反应式: 2Ag + Cu2+ + 2I = 2AgI + Cu
(AgI/Ag) = (Ag+/Ag) + 0.0591 lg Ksp(AgI) = 0.80 + 0.059 lg(1.0 10-18) = -0.26 (V)
= (Cu2+/Cu) – (AgI/Ag) = 0.34 - (-0.26) = 0.60 (V)
lg = / 0.0591 = 2 0.60 / 0.0591 = 20.34
所以平衡常数 = 2.2 1020
解析
步骤 1:计算Cu2+/Cu电极的电极电势
根据能斯特方程,计算Cu2+/Cu电极的电极电势。已知标准电极电势 (Cu2+/Cu) = 0.34 V,[Cu2+] = 0.010 mol·dm-3。
步骤 2:计算AgI/Ag电极的电极电势
根据能斯特方程,计算AgI/Ag电极的电极电势。已知标准电极电势 (Ag+/Ag) = 0.80 V,[I] = 0.10 mol·dm-3,Ksp(AgI) = 1.0 10-18。
步骤 3:确定原电池的符号和电池反应式
根据电极电势的大小,确定原电池的符号和电池反应式。
步骤 4:计算电池反应的平衡常数
根据电池反应的电极电势差,计算电池反应的平衡常数。
根据能斯特方程,计算Cu2+/Cu电极的电极电势。已知标准电极电势 (Cu2+/Cu) = 0.34 V,[Cu2+] = 0.010 mol·dm-3。
步骤 2:计算AgI/Ag电极的电极电势
根据能斯特方程,计算AgI/Ag电极的电极电势。已知标准电极电势 (Ag+/Ag) = 0.80 V,[I] = 0.10 mol·dm-3,Ksp(AgI) = 1.0 10-18。
步骤 3:确定原电池的符号和电池反应式
根据电极电势的大小,确定原电池的符号和电池反应式。
步骤 4:计算电池反应的平衡常数
根据电池反应的电极电势差,计算电池反应的平衡常数。