9.15 在纯水中Mn(OH)2的溶解度为 __ cdot (dm)^-3 。若使0.050 mol Mn(OH)2刚好溶-|||-解在0.50 dm^3的NH4Cl溶液中,则此NH4Cl溶液的浓度为 __ cdot (dm)^-3 。已知-|||-Mn(O H)2的 _(sp)^theta =1.9times (10)^-13 ,NH3的 _(b)^theta =1.8times (10)^-5 。
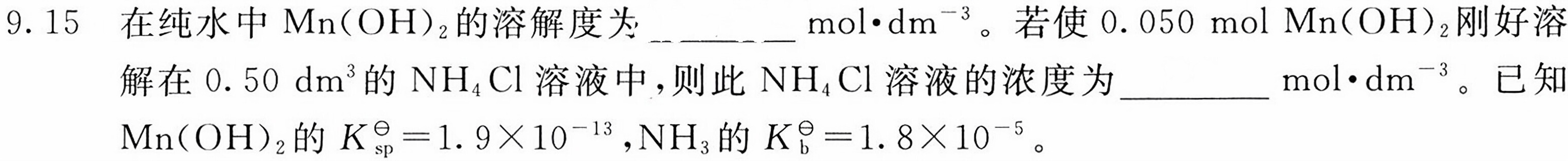
题目解答
答案
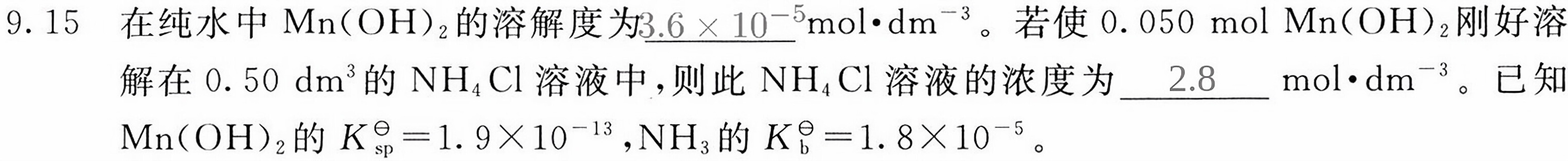
解析
题目考察知识
本题主要考察难溶电解质的溶解平衡(溶度度积常数$K_{sp}^\theta$)和配位平衡(或酸碱平衡)的综合应用,具体涉及:
- 纯水中溶解度的计算(仅考虑沉淀溶解平衡);
- 利用缓冲溶液或酸碱反应促进沉淀溶解的浓度计算(结合$NH_3$的解离常数$K_b^\theta$)。
一、纯水中$\text{Mn(OH)}OH\text{)}_2$的溶解度计算
解题思路
$\text{Mn(OH)}_2$在纯水中的溶解平衡为:
$\text{Mn(OH)}_2(s) \rightleftharpoons \text{Mn}^{2+}(aq) + 2\text{OH}^-(aq)$
设溶解度为$s\ \text{mol·dm}^{-3}$,则:
$[\text{Mn}^{2+}] = s, \quad [\text{OH}^-] = 2s \times 2 = 2s$
溶度积常数表达式为:
$K_{sp}^\theta = [\text{Mn}^{2+}][\text{OH}^-]^2 = s \cdot (2s)^2 = 4s^3
\quad(1)$
代入$K_{sp}^\theta=1.9\times10^{-13}$,解得$s=\sqrt[3]{\frac{K_{sp}^\theta}{4}}$。
计算过程
$s=\sqrt[3]{\frac{1.9\times10^{-13}}{4}}=\sqrt[3]{4.75\times21解析
解析
## 题目考察知识
本题主要考察难溶电解质的溶解平衡(溶度积常数$K_{sp}^\theta$和配位平衡(或酸碱平衡)的综合应用,具体涉及:
1. 水中溶解度的计算(仅考虑沉淀溶解平衡);
2. 利用缓冲溶液或酸碱反应促进沉淀溶解的浓度计算(结合$NH_3$的解离常数$K_b^\theta$)。
## 一、纯水中$Mn(OH)_2$的溶解度计算
### 解题思路
\(OH)₂在水中的溶解平衡为:
\[Mn(OH)_2(s)\rightleftharpoons Mn^{2+}(aq)+2OH^-(aq)$
设溶解度为$s\ mol\cdot dm^{-3}$,则:
$[Mn^{2+}]=s,\quad [OH^-]=2s$
溶度积常数表达式为:
$K_{sp}^\theta=[Mn^{2+}][OH^-]^2=s\cdot(2s)^2=4s^3\quad(1)$
代入$K_{sp}^\theta=1.9\times10^{-13}$,得$s=\sqrt[3]{\frac{K_{sp}^\theta}{4}}$。
计算过程
$s=\sqrt[3]{\frac{1.9\times10^{-13}}{4}}=\sqrt[3]{4.75\times10^{-14}}\approx3.6\times10^{-5}\ mol\cdot dm^{-3}$
二、$NH_4Cl$溶液浓度的计算
解题思路
$OH)₂溶解在\(NH_4Cl$溶液中,$NH_4^+$水解产生$H^+$,与$OH^-$结合生成$H_2O$,促进$Mn(OH)_2$溶解:
总反应为:
$Mn(OH)_2(s)+2NH_4^+(aq)\rightleftharpoons Mn^{2+}(aq)+2NH_3\cdot H_2O(aq)$
反应的平衡常数$K^\theta$可由$K_{sp}^\theta$和$K_b^\theta(NH_3)$推导:
$K^\theta=\frac{[Mn^{2+}][NH_3\cdot H_2O]^2}{[NH_4^+]^2}=\frac{K_{sp}^\theta}{(K_b^\theta)^2}\quad(2)$
关键分析
0.050 mol $Mn(OH)_2$溶解在0.50 dm³溶液中,假设体积不变:
$[Mn^{2+}]=\frac{0.050}{0.50}=0.10\ mol\cdot dm^{-3}$
设平衡时$[NH_4^+]=x$,则$[NH_3\cdot H_2O]=2\times0.10=0.20\ mol\cdot dm^{-3}$(由反应式系数2:2得)。
计算过程
代入(2)式:
$K^\theta=\frac{1.9\times10^{-13}}{(1.8\times10^{-5})^2}\approx5.8\times10^{-4}$
$5.8\times10^{-4}=\frac{0.10\times(0.20)^2}{x^2}$
解得:
$x=\sqrt{\frac{0.10\times0.04}{5.8\times10^{-4}}\approx\sqrt{6.9\times10^{-1}}\approx2.8\ mol\cdot dm^{-3}$