题目
习题18 试计算 -(10)^circ C 标准压力下,1.mol·的过冷水变成冰这一过程的 Delta S, 并与实际-|||-过程的热温商比较以判断此过程能否进行。已知水和冰的热容分别为 .184] cdot (K)^--|||-和 .092] cdot (K)^-1cdot (g)^-1 0℃时冰的熔化焓 (Delta )_(100)(H)^theta =334.72Jcdot g-|||-[答案: -20.7] cdot (K)^-1cdot mol; -21.5] cdot (K)^-1cdot molcdot (I)^n

题目解答
答案
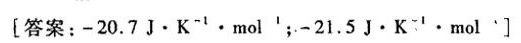
解析
步骤 1:计算水从 $-10^{\circ}C$ 升温至 $0^{\circ}C$ 的熵变
水的热容为 $4.184J\cdot K^{-1}\cdot mol^{-1}$,因此,水从 $-10^{\circ}C$ 升温至 $0^{\circ}C$ 的熵变 $\Delta S_1$ 可以通过以下公式计算:
$$
\Delta S_1 = \int_{T_1}^{T_2} \frac{C_p}{T} dT = C_p \ln \frac{T_2}{T_1}
$$
其中,$T_1 = 263.15K$,$T_2 = 273.15K$,$C_p = 4.184J\cdot K^{-1}\cdot mol^{-1}$。
步骤 2:计算水在 $0^{\circ}C$ 时的相变熵变
水在 $0^{\circ}C$ 时的相变熵变 $\Delta S_2$ 可以通过以下公式计算:
$$
\Delta S_2 = \frac{\Delta H_{fus}}{T}
$$
其中,$\Delta H_{fus} = 334.72J\cdot g^{-1}$,$T = 273.15K$。
步骤 3:计算冰从 $0^{\circ}C$ 降温至 $-10^{\circ}C$ 的熵变
冰的热容为 $2.092J\cdot K^{-1}\cdot g^{-1}$,因此,冰从 $0^{\circ}C$ 降温至 $-10^{\circ}C$ 的熵变 $\Delta S_3$ 可以通过以下公式计算:
$$
\Delta S_3 = \int_{T_2}^{T_1} \frac{C_p}{T} dT = C_p \ln \frac{T_1}{T_2}
$$
其中,$T_1 = 263.15K$,$T_2 = 273.15K$,$C_p = 2.092J\cdot K^{-1}\cdot g^{-1}$。
步骤 4:计算总熵变
总熵变 $\Delta S$ 为上述三个熵变之和:
$$
\Delta S = \Delta S_1 + \Delta S_2 + \Delta S_3
$$
步骤 5:计算实际过程的热温商
实际过程的热温商 $\Delta S_{实际}$ 可以通过以下公式计算:
$$
\Delta S_{实际} = \frac{Q}{T}
$$
其中,$Q$ 为实际过程中的热量,$T$ 为温度。
步骤 6:判断过程能否进行
如果 $\Delta S_{实际} \geq \Delta S$,则过程可以进行;否则,过程不能进行。
水的热容为 $4.184J\cdot K^{-1}\cdot mol^{-1}$,因此,水从 $-10^{\circ}C$ 升温至 $0^{\circ}C$ 的熵变 $\Delta S_1$ 可以通过以下公式计算:
$$
\Delta S_1 = \int_{T_1}^{T_2} \frac{C_p}{T} dT = C_p \ln \frac{T_2}{T_1}
$$
其中,$T_1 = 263.15K$,$T_2 = 273.15K$,$C_p = 4.184J\cdot K^{-1}\cdot mol^{-1}$。
步骤 2:计算水在 $0^{\circ}C$ 时的相变熵变
水在 $0^{\circ}C$ 时的相变熵变 $\Delta S_2$ 可以通过以下公式计算:
$$
\Delta S_2 = \frac{\Delta H_{fus}}{T}
$$
其中,$\Delta H_{fus} = 334.72J\cdot g^{-1}$,$T = 273.15K$。
步骤 3:计算冰从 $0^{\circ}C$ 降温至 $-10^{\circ}C$ 的熵变
冰的热容为 $2.092J\cdot K^{-1}\cdot g^{-1}$,因此,冰从 $0^{\circ}C$ 降温至 $-10^{\circ}C$ 的熵变 $\Delta S_3$ 可以通过以下公式计算:
$$
\Delta S_3 = \int_{T_2}^{T_1} \frac{C_p}{T} dT = C_p \ln \frac{T_1}{T_2}
$$
其中,$T_1 = 263.15K$,$T_2 = 273.15K$,$C_p = 2.092J\cdot K^{-1}\cdot g^{-1}$。
步骤 4:计算总熵变
总熵变 $\Delta S$ 为上述三个熵变之和:
$$
\Delta S = \Delta S_1 + \Delta S_2 + \Delta S_3
$$
步骤 5:计算实际过程的热温商
实际过程的热温商 $\Delta S_{实际}$ 可以通过以下公式计算:
$$
\Delta S_{实际} = \frac{Q}{T}
$$
其中,$Q$ 为实际过程中的热量,$T$ 为温度。
步骤 6:判断过程能否进行
如果 $\Delta S_{实际} \geq \Delta S$,则过程可以进行;否则,过程不能进行。