题目
某锅炉燃用煤气的成分如下:H2S0.2%;CO25%;O20.2%;CO28.5%;H213.0%;CH40.7%;N252.4%;空气含湿量为12g/m3N,alpha =1.2,试求实际需要的空气量和燃烧时产生的实际烟气量。
某锅炉燃用煤气的成分如下:H2S0.2%;CO25%;O20.2%;CO28.5%;H213.0%;CH40.7%;N252.4%;空气含湿量为12g/m3N,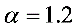 ,试求实际需要的空气量和燃烧时产生的实际烟气量。
,试求实际需要的空气量和燃烧时产生的实际烟气量。
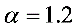 ,试求实际需要的空气量和燃烧时产生的实际烟气量。
,试求实际需要的空气量和燃烧时产生的实际烟气量。题目解答
答案
解:
取1mol煤气计算
H2S 0.002mol 耗氧量 0.003mol
CO2 0.05mol 0
CO 0.285mol 0.143mol
H2 (0.13-0.004)mol 0.063mol
CH4 0.007mol 0.014mol
共需O2 0.003+0.143+0.063+0.014=0.223mol。设干空气中N2:O2体积比为3.78:1,则理论干空气量为0.223×(3.78+1)=1.066mol。取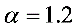 ,则实际干空气 1.2×1.066mol=1.279mol。
,则实际干空气 1.2×1.066mol=1.279mol。
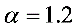 ,则实际干空气 1.2×1.066mol=1.279mol。
,则实际干空气 1.2×1.066mol=1.279mol。空气含湿量为12g/m3N,即含H2O0.67mol/ m3N,14.94L/ m3N。故H2O体积分数为1.493%。故实际空气量为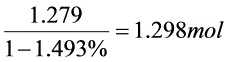 。
。
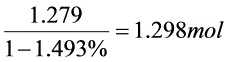 。
。烟气量SO2:0.002mol,CO2:0.285+0.007+0.05=0.342mol,N2:0.223×3.78+0.524=1.367mol,H2O0.002+0.126+0.014+1.298×1.493%+0.004=0.201mol
故实际烟气量 0.002+0.342+1.367+0.201+0.2×1.066=2.125mol
解析
步骤 1:计算各成分的摩尔数
根据题目中给出的煤气成分,我们可以计算出每种成分的摩尔数。假设我们有1mol的煤气,那么每种成分的摩尔数为:
- H2S: 0.002mol
- CO2: 0.05mol
- O2: 0.002mol
- CO: 0.285mol
- H2: 0.13mol
- CH4: 0.007mol
- N2: 0.524mol
步骤 2:计算各成分的耗氧量
根据各成分的化学反应,我们可以计算出它们的耗氧量。耗氧量的计算基于以下反应:
- H2S + 2O2 -> SO2 + H2O
- CO + 1/2O2 -> CO2
- H2 + 1/2O2 -> H2O
- CH4 + 2O2 -> CO2 + 2H2O
- O2: 0.002mol
- CO: 0.285mol * 1/2 = 0.143mol
- H2: 0.13mol * 1/2 = 0.065mol
- CH4: 0.007mol * 2 = 0.014mol
- H2S: 0.002mol * 2 = 0.004mol
总耗氧量为:0.004 + 0.143 + 0.065 + 0.014 = 0.226mol
步骤 3:计算理论干空气量
假设干空气中N2:O2体积比为3.78:1,那么理论干空气量为0.226×(3.78+1)=1.066mol。
步骤 4:计算实际干空气量
取$\alpha =1.2$,则实际干空气量为1.2×1.066mol=1.279mol。
步骤 5:计算实际空气量
空气含湿量为12g/m3N,即含H2O0.67mol/ m3N,14.94L/ m3N。故H2O体积分数为1.493%。故实际空气量为$\dfrac {1.279}{1-1.493\% }=1.298mol$。
步骤 6:计算实际烟气量
烟气量包括SO2、CO2、N2和H2O的摩尔数。根据各成分的化学反应,我们可以计算出它们的摩尔数。计算如下:
- SO2: 0.002mol
- CO2: 0.285+0.007+0.05=0.342mol
- N2: 0.226×3.78+0.524=1.367mol
- H2O: 0.002+0.143+0.014+1.298×1.493%+0.004=0.201mol
故实际烟气量为0.002+0.342+1.367+0.201+0.2×1.066=2.125mol
根据题目中给出的煤气成分,我们可以计算出每种成分的摩尔数。假设我们有1mol的煤气,那么每种成分的摩尔数为:
- H2S: 0.002mol
- CO2: 0.05mol
- O2: 0.002mol
- CO: 0.285mol
- H2: 0.13mol
- CH4: 0.007mol
- N2: 0.524mol
步骤 2:计算各成分的耗氧量
根据各成分的化学反应,我们可以计算出它们的耗氧量。耗氧量的计算基于以下反应:
- H2S + 2O2 -> SO2 + H2O
- CO + 1/2O2 -> CO2
- H2 + 1/2O2 -> H2O
- CH4 + 2O2 -> CO2 + 2H2O
- O2: 0.002mol
- CO: 0.285mol * 1/2 = 0.143mol
- H2: 0.13mol * 1/2 = 0.065mol
- CH4: 0.007mol * 2 = 0.014mol
- H2S: 0.002mol * 2 = 0.004mol
总耗氧量为:0.004 + 0.143 + 0.065 + 0.014 = 0.226mol
步骤 3:计算理论干空气量
假设干空气中N2:O2体积比为3.78:1,那么理论干空气量为0.226×(3.78+1)=1.066mol。
步骤 4:计算实际干空气量
取$\alpha =1.2$,则实际干空气量为1.2×1.066mol=1.279mol。
步骤 5:计算实际空气量
空气含湿量为12g/m3N,即含H2O0.67mol/ m3N,14.94L/ m3N。故H2O体积分数为1.493%。故实际空气量为$\dfrac {1.279}{1-1.493\% }=1.298mol$。
步骤 6:计算实际烟气量
烟气量包括SO2、CO2、N2和H2O的摩尔数。根据各成分的化学反应,我们可以计算出它们的摩尔数。计算如下:
- SO2: 0.002mol
- CO2: 0.285+0.007+0.05=0.342mol
- N2: 0.226×3.78+0.524=1.367mol
- H2O: 0.002+0.143+0.014+1.298×1.493%+0.004=0.201mol
故实际烟气量为0.002+0.342+1.367+0.201+0.2×1.066=2.125mol