题目
8.300K时,1 mol 理想气体作等温可逆膨胀,起始压强为1500 kPa,终态体积为10 dm^3。试计算该过-|||-程的Q,W, Delta V 和 △H。

题目解答
答案
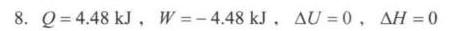
解析
步骤 1:计算起始体积
根据理想气体状态方程 $PV=nRT$,其中 $n=1$ mol,$R=8.314$ J/(mol·K),$T=300$ K,$P=1500$ kPa,可以计算出起始体积 $V_1$。
步骤 2:计算体积变化 $\Delta V$
$\Delta V = V_2 - V_1$,其中 $V_2=10$ dm^3。
步骤 3:计算等温可逆膨胀过程的功 $W$
对于理想气体的等温可逆膨胀过程,功 $W$ 可以用公式 $W=-nRT\ln\frac{V_2}{V_1}$ 计算。
步骤 4:计算热量 $Q$
根据热力学第一定律,$Q=\Delta U + W$,其中 $\Delta U=0$(因为是等温过程)。
步骤 5:计算焓变 $\Delta H$
对于理想气体,$\Delta H = \Delta U + \Delta (PV)$,其中 $\Delta U=0$,$\Delta (PV)=0$(因为是等温过程)。
根据理想气体状态方程 $PV=nRT$,其中 $n=1$ mol,$R=8.314$ J/(mol·K),$T=300$ K,$P=1500$ kPa,可以计算出起始体积 $V_1$。
步骤 2:计算体积变化 $\Delta V$
$\Delta V = V_2 - V_1$,其中 $V_2=10$ dm^3。
步骤 3:计算等温可逆膨胀过程的功 $W$
对于理想气体的等温可逆膨胀过程,功 $W$ 可以用公式 $W=-nRT\ln\frac{V_2}{V_1}$ 计算。
步骤 4:计算热量 $Q$
根据热力学第一定律,$Q=\Delta U + W$,其中 $\Delta U=0$(因为是等温过程)。
步骤 5:计算焓变 $\Delta H$
对于理想气体,$\Delta H = \Delta U + \Delta (PV)$,其中 $\Delta U=0$,$\Delta (PV)=0$(因为是等温过程)。