由软锰矿二氧化锰制备金属锰可采取下列两种方法:(1)MnO2(s) + 2H2(g) Mn (s) + 2H2O(g);(2)MnO2(s) + 2C(s) Mn(s) + 2CO(g);上述两个反应在 25℃, 100 kPa 下是否能自发进行?如果考虑工作温度愈低愈好的话,则制备锰采用哪一 种方法比较好?
题目解答
答案
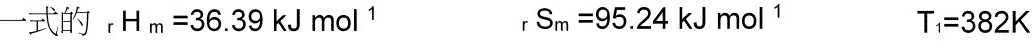
解析
考查要点:本题主要考查化学反应的自发性判断,涉及吉布斯自由能(ΔG)、焓变(ΔH)、熵变(ΔS)的计算与分析,以及温度对反应自发性的影响。
解题核心思路:
- 判断反应是否自发:通过计算ΔG(ΔG = ΔH - TΔS),若ΔG < 0,反应自发;反之则不自发。
- 比较两种方法的温度敏感性:通过ΔH和ΔS的大小关系,分析不同温度下ΔG的变化趋势,选择临界温度更低的反应(即在更低温度下即可自发的反应)。
破题关键点:
- 数据处理:正确计算ΔH和ΔS,代入公式求ΔG。
- 临界温度分析:通过ΔH和ΔS计算临界温度(T = ΔH/ΔS),比较两种方法的临界温度,选择更低温适用的反应。
反应(1)的分析
-
计算ΔG:
$\Delta G = \Delta H - T\Delta S = 36.39 \, \text{kJ/mol} - (298 \, \text{K} \times 0.09524 \, \text{kJ/(mol·K)}) \approx 8.98 \, \text{kJ/mol} > 0$
因此,反应(1)在25℃下不能自发。 -
临界温度:
$T_1 = \frac{\Delta H}{\Delta S} = \frac{36.39 \, \text{kJ/mol}}{0.09524 \, \text{kJ/(mol·K)}} \approx 382 \, \text{K}$
当温度高于382 K时,ΔG < 0,反应可自发。
反应(2)的分析
-
计算ΔG:
$\Delta G = \Delta H - T\Delta S = 298.98 \, \text{kJ/mol} - (298 \, \text{K} \times 0.36228 \, \text{kJ/(mol·K)}) \approx 191.8 \, \text{kJ/mol} > 0$
因此,反应(2)在25℃下不能自发。 -
临界温度:
$T_2 = \frac{\Delta H}{\Delta S} = \frac{298.98 \, \text{kJ/mol}}{0.36228 \, \text{kJ/(mol·K)}} \approx 825 \, \text{K}$
当温度高于825 K时,ΔG < 0,反应可自发。
温度对方法选择的影响
- 反应(1)的临界温度为382 K,反应(2)为825 K。若要求工作温度尽可能低,则反应(1)更优,因其在更低温度下即可达到自发条件。