题目
氢能是一种极具发展潜力的清洁能源。下列反应是目前大规模制取氢气的方法之一、(g)+(H)_(2)O(g)=!=!= C(O)_(2)(g)+(H)_(2)(g)(g)+(H)_(2)O(g)=!=!= C(O)_(2)(g)+(H)_(2)(g)(1)在生产中,欲使CO的转化率提高,同时提高(g)+(H)_(2)O(g)=!=!= C(O)_(2)(g)+(H)_(2)(g)的产率,可采取哪些措施___________?(2)在容积不变的密闭容器中,将2.0molCO与8.0mol(g)+(H)_(2)O(g)=!=!= C(O)_(2)(g)+(H)_(2)(g)混合加热到830℃发生上述反应,达到平衡时CO的转化率是80%。计算该反应的平衡常数___________。(3)实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以明显提高(g)+(H)_(2)O(g)=!=!= C(O)_(2)(g)+(H)_(2)(g)的体积分数。对比实验的结果如图所示。(g)+(H)_(2)O(g)=!=!= C(O)_(2)(g)+(H)_(2)(g)请思考:投入CaO时,(g)+(H)_(2)O(g)=!=!= C(O)_(2)(g)+(H)_(2)(g)的体积分数为什么会增大___________?微米CaO和纳米CaO对平衡的影响为何不同___________?
氢能是一种极具发展潜力的清洁能源。下列反应是目前大规模制取氢气的方法之一、
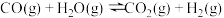
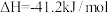
(1)在生产中,欲使CO的转化率提高,同时提高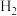 的产率,可采取哪些措施
的产率,可采取哪些措施___________ ?
(2)在容积不变的密闭容器中,将2.0molCO与8.0mol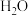 混合加热到830℃发生上述反应,达到平衡时CO的转化率是80%。计算该反应的平衡常数
混合加热到830℃发生上述反应,达到平衡时CO的转化率是80%。计算该反应的平衡常数___________ 。
(3)实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以明显提高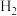 的体积分数。对比实验的结果如图所示。
的体积分数。对比实验的结果如图所示。
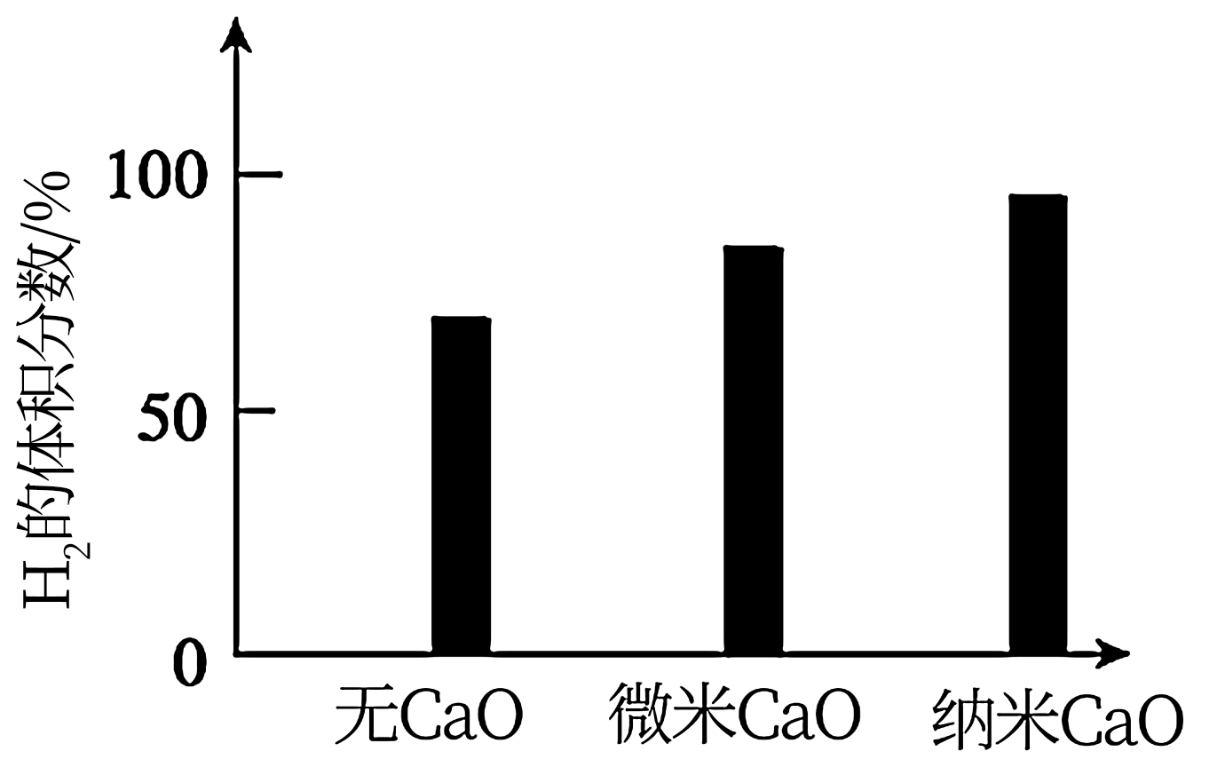
请思考:投入CaO时,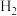 的体积分数为什么会增大
的体积分数为什么会增大___________ ?微米CaO和纳米CaO对平衡的影响为何不同___________ ?
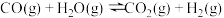
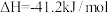
(1)在生产中,欲使CO的转化率提高,同时提高
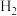 的产率,可采取哪些措施
的产率,可采取哪些措施(2)在容积不变的密闭容器中,将2.0molCO与8.0mol
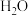 混合加热到830℃发生上述反应,达到平衡时CO的转化率是80%。计算该反应的平衡常数
混合加热到830℃发生上述反应,达到平衡时CO的转化率是80%。计算该反应的平衡常数(3)实验发现,其他条件不变,在相同时间内,向上述体系中投入一定量的CaO可以明显提高
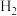 的体积分数。对比实验的结果如图所示。
的体积分数。对比实验的结果如图所示。
请思考:投入CaO时,
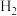 的体积分数为什么会增大
的体积分数为什么会增大题目解答
答案

解析
- 第(1)题:考查化学平衡移动原理。关键点在于通过改变温度、浓度等条件使平衡正向移动,从而提高CO的转化率和H₂的产率。
- 第(2)题:考查平衡常数的计算。需根据初始物质的量、转化率计算各物质的平衡浓度,代入平衡常数公式。
- 第(3)题:考查固体对平衡的影响及催化剂颗粒大小对反应速率的作用。关键点是CaO与CO₂反应改变平衡,纳米颗粒因表面积大反应更快。
第(1)题
措施分析:
- 降低温度:反应为放热(ΔH < 0),降温使平衡右移。
- 增大水蒸气浓度:增加反应物浓度,平衡右移,提高CO转化率。
第(2)题
计算平衡浓度
- 初始物质的量:
CO: 2.0 mol,H₂O: 8.0 mol,CO₂: 0,H₂: 0 - 转化量:
CO转化率80%,转化量为 $2.0 \times 0.8 = 1.6$ mol
CO₂和H₂生成量均为1.6 mol,H₂O消耗1.6 mol - 平衡时物质的量:
CO: $2.0 - 1.6 = 0.4$ mol
H₂O: $8.0 - 1.6 = 6.4$ mol
CO₂: $1.6$ mol
H₂: $1.6$ mol
代入平衡常数公式
$K = \frac{[CO_2][H_2]}{[CO][H_2O]} = \frac{(1.6/V)(1.6/V)}{(0.4/V)(6.4/V)} = \frac{2.56}{2.56} = 1$
第(3)题
增大H₂体积分数的原因
- CaO的作用:CaO与CO₂反应生成CaCO₃,减少CO₂浓度,平衡正向移动,H₂体积分数增大。
纳米CaO与微米CaO的区别
- 纳米颗粒表面积更大:反应速率更快,在相同时间内去除更多CO₂,平衡移动更显著。