二、常见比例型题(均按当年高考题照排) 例1(1995-17) 将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为A.1∶2∶3B.3∶2∶1C.6∶3∶1D.6∶3∶2[错解] A。[评析] 突破口是写出电极反应式,使金属阳离子得电子的物质的量相等,便可找到析出钾、镁、铝的物质的量之比。K++e=K,Mg2++2e=Mg,Al3++3e=Al,2与3的最小公倍数为6。我们可以认为在一定条件下通电一段时间后,串联电路中有6mol6∶3∶2。故选D.为答案。误选A.为答案,是由于误把钾、镁、铝失电子的物质的量之比,当成了析出钾、镁、铝的物质的量之比,导致失误。[正确答案] D。例2(1996-17) 用10.L的0.1mol/LBaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是A.3∶2∶2B.1∶2∶3C.1∶3∶3D.3∶1∶1[错解] D。[评析] BaCl2物质的量应该相同,我们可把10.L的0.1mol·L-1BaCl2溶液看成1L1mol·L-1的BaCl2溶液,把“相同体积”的三种硫酸盐溶液的体积看成为各1L。这就决定了消耗三种硫酸盐溶液中的硫酸根的物质的量相等,这时再求三种硫酸盐溶液的物质的量浓度之比就容易了。误选D为答案,是由于误把1molFe2(SO4)3、1molZnSO4、盐溶液的物质的量浓度之比,导致失误。[正确答案] C。例3(1.95-24. 在反应X+2Y==R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR,则在此反应中Y和M的质量之比为A.16∶9B.23∶9C.32∶9D.46∶9[错解] B。[评析] 审视题干,给出生成R的质量,又知R和M的摩尔质量之比为22∶9,可在化学方程式中按质量比找到M的质量(设为M′),然后根据质量守恒定律,求出Y的质量(设为Y′),便可算出Y和M的质量之比(即Y′∶M′)。X+2Y=R + 2M22 9×24.4g M′22∶9×2=4.4g∶M′M′=3.6g根据1.6g+Y′=4.4g+3.6g可得 Y′=6.4g故Y′∶M′=6.4g∶3.6g=16∶9,选A为答案。出现误选B.为答案,是由于关系量找错,导致失误。即: X+2Y=R + 2M22 94.4g M′22∶9=4.4g∶M′M′=1.8g根据1.6g+Y′=4.4g+1.8gY′=4.6g故Y′∶M′=4.6g∶1.8g=23∶9。[正确答案] A。例4(1998-18) pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是A.11∶1B.9∶1C.1∶11D.1∶9[错解] ①B,②C。[评析] 本题可按部就班求算,也可以估算。根据pH=13的强碱溶液,可知该溶液中的〔OH-〕为1×10-1mol·L-1。根据pH=2的强酸溶液,可知该溶液中的〔H+〕为1×10-2mol·L-1。二者混合后,所得溶液的pH=11,可知混合液中[OH-]为1×10-3mol·L-1。设强碱的体积为xL,强酸的体积为yL,可列式思维敏捷的考生可以估算。因为[OH-]=1×10-1mol·L-1,[H+]=1×10-2mol·L-1,若二者体积比为1∶10时,溶液呈中性;若二者体积比为1∶11时,溶液呈酸性;要使混合液呈碱性,二者体积比为1∶9,故选D为答案。出现①误区,是由于把强碱与强酸的体积比误答成了强酸与强碱的体积比,造成失误。出现②误区,是由于估算时,把溶液的酸碱性判断错了,造成了失误。[正确答案] D。本题属于有关pH值计算类型的基础题,要保证不陷入误区,还需掌握有关溶液pH值与氢离子浓度、氢氧根离子浓度的简单计算,并且有必要追寻1988年至1999年以来命题轨迹,体会有关pH值及其计算可能有哪些变化?应如何回答?附:1988~1999年溶液的pH值及其计算试题(均按当年试题照排)(1)求混合溶液的pH值1988/二、25.0.1mol的下列氧化物,分别加入1L0.1MNaOH溶液中,形成的溶液的pH值最小的是 A.二氧化氮B.二氧化碳 C.二氧化硫D.三氧化硫答案[D]1.88/二、11.99mL0.1M盐酸和101mL0.05M氢氧化钡溶液相混和后,溶液的pH值为A.1.7B.10.7C.11D.1..3答案[C]1989/A、二、17.99mL0.5mol/L硫酸跟101mL1mol/L氢氧化钠溶液混和后,溶液的pH值为A.0.4B.2C.12D.13.6答案[C]1992/二、16.等体积混和0.10mol/L盐酸和0.06mol/LBa(OH)2溶液后,溶液的pH值等于A.2.0B.12.3C.1.7D.12.0答案[D]1999/18.用0.1mol·L-1NaOH溶液滴定0.1mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是A.4B.7.2C.10D.1..3答案[C](2)根据溶液pH值求[H+]或[OH-]1988/二、6.将pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混和后,溶液中的氢离子浓度最接近于 答案[D]1990/三、28.把80mLNaOH溶液加入到120mL盐酸中,所得溶液的pH值为2。如果混和前NaOH溶液和盐酸的摩尔浓度相同,它们的浓度是A.0.5mol/LB.0.1mol/L C.0.05mol/LD.1mol/L答案[C](3)根据溶液的pH值求体积比1998.18.PH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是A.11∶1B.9∶1C.1∶11D.1∶9答案[D](4)水的离子积Kw与pH值1989/A.一、10.90℃时水的离子积Kw=3.8×10-13,该温度时纯水的pH值A.等于7B.小于7C.大于7D.无法确定 答案[B]1991/五、36.在80℃时,纯水的pH值小于7,为什么?(答:已知室温时,纯水中的[H+]=[OH-]=10-7mol·L-1,又因水的离解(H2O=[OH-]>10-7mol·L-1,即pH<7。)(5)α与pH值的有关计算1997/23.若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为A.10(a+b-12)%B.10(a+b-14)%C.10(12-a-b)%D.10(14-a-b)% 答案[A](6)强酸与弱酸溶液中[H+]与pH值的关系1989/A.二、14.pH值和体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下,放出二氧化碳气体的体积是A.一样多B.醋酸比硫酸多C.硫酸比醋酸多D.无法比较 答案[B](7)pH值与电离平衡移动的关系1989/A.二、15.在10.mL0.1mol/L醋酸溶液中,欲使醋酸的电离度和溶液的pH值都增大,可以采用的方法是A.加少量1mol/L氢氧化钠溶液B.加少量1mol/L盐酸C.加100mL水D.加热 答案[A,C](8)pH试纸的使用1992/一、5.用pH试纸测定某无色溶液的pH值时,规范的操作是A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较B.将溶液倒在pH试纸上,跟标准比色卡比较C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 答案[C](9)电解后溶液pH值的变化规律1992/二、14.用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH值保持不变的是A.HClB.NaOHC.Na2SO4D.NaCl 答案[C](10)酸碱盐溶液pH值大小的比较1991/35.浓度均为0.1mol/L的8种溶液:①HNO3 ②H2SO4 ③HCOOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl,溶液pH值由小到大的顺序是:(填写编号)
A.1∶2∶3
B.3∶2∶1
C.6∶3∶1
D.6∶3∶2[错解] A。[评析] 突破口是写出电极反应式,使金属阳离子得电子的物质的量相等,便可找到析出钾、镁、铝的物质的量之比。K++e=K,Mg2++2e=Mg,Al3++3e=Al,2与3的最小公倍数为6。我们可以认为在一定条件下通电一段时间后,串联电路中有6mol6∶3∶2。故选
D.为答案。误选
A.为答案,是由于误把钾、镁、铝失电子的物质的量之比,当成了析出钾、镁、铝的物质的量之比,导致失误。[正确答案] D。例2(1996-17) 用1
0.L的0.1mol/LBaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的摩尔浓度之比是
A.3∶2∶2
B.1∶2∶3
C.1∶3∶3
D.3∶1∶1[错解] D。[评析] BaCl2物质的量应该相同,我们可把1
0.L的0.1mol·L-1BaCl2溶液看成1L1mol·L-1的BaCl2溶液,把“相同体积”的三种硫酸盐溶液的体积看成为各1L。这就决定了消耗三种硫酸盐溶液中的硫酸根的物质的量相等,这时再求三种硫酸盐溶液的物质的量浓度之比就容易了。误选D为答案,是由于误把1molFe2(SO4)3、1molZnSO4、盐溶液的物质的量浓度之比,导致失误。[正确答案] C。例3(
1.95-2
4. 在反应X+2Y==R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4gR,则在此反应中Y和M的质量之比为
A.16∶9
B.23∶9
C.32∶9
D.46∶9[错解] B。[评析] 审视题干,给出生成R的质量,又知R和M的摩尔质量之比为22∶9,可在化学方程式中按质量比找到M的质量(设为M′),然后根据质量守恒定律,求出Y的质量(设为Y′),便可算出Y和M的质量之比(即Y′∶M′)。X+2Y=R + 2M22 9×2
4.4g M′22∶9×2=
4.4g∶M′M′=
3.6g根据
1.6g+Y′=
4.4g+
3.6g可得 Y′=
6.4g故Y′∶M′=
6.4g∶
3.6g=16∶9,选A为答案。出现误选
B.为答案,是由于关系量找错,导致失误。即: X+2Y=R + 2M22 9
4.4g M′22∶9=
4.4g∶M′M′=
1.8g根据
1.6g+Y′=
4.4g+1.8gY′=
4.6g故Y′∶M′=
4.6g∶
1.8g=23∶9。[正确答案] A。例4(1998-18) pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是
A.11∶1
B.9∶1
C.1∶11
D.1∶9[错解] ①B,②C。[评析] 本题可按部就班求算,也可以估算。根据pH=13的强碱溶液,可知该溶液中的〔OH-〕为1×10-1mol·L-1。根据pH=2的强酸溶液,可知该溶液中的〔H+〕为1×10-2mol·L-1。二者混合后,所得溶液的pH=11,可知混合液中[OH-]为1×10-3mol·L-1。设强碱的体积为xL,强酸的体积为yL,可列式思维敏捷的考生可以估算。因为[OH-]=1×10-1mol·L-1,[H+]=1×10-2mol·L-1,若二者体积比为1∶10时,溶液呈中性;若二者体积比为1∶11时,溶液呈酸性;要使混合液呈碱性,二者体积比为1∶9,故选D为答案。出现①误区,是由于把强碱与强酸的体积比误答成了强酸与强碱的体积比,造成失误。出现②误区,是由于估算时,把溶液的酸碱性判断错了,造成了失误。[正确答案] D。本题属于有关pH值计算类型的基础题,要保证不陷入误区,还需掌握有关溶液pH值与氢离子浓度、氢氧根离子浓度的简单计算,并且有必要追寻1988年至1999年以来命题轨迹,体会有关pH值及其计算可能有哪些变化?应如何回答?附:1988~1999年溶液的pH值及其计算试题(均按当年试题照排)(1)求混合溶液的pH值1988/二、2
5.
0.1mol的下列氧化物,分别加入1L0.1MNaOH溶液中,形成的溶液的pH值最小的是
A.二氧化氮
B.二氧化碳
C.二氧化硫
D.三氧化硫答案[D]
1.88/二、11.99mL
0.1M盐酸和101mL0.05M氢氧化钡溶液相混和后,溶液的pH值为
A.
1.7
B.1
0.7
C.11
D.
1..3答案[C]1989/A、二、1
7.99mL
0.5mol/L硫酸跟101mL1mol/L氢氧化钠溶液混和后,溶液的pH值为
A.
0.4
B.2
C.12
D.1
3.6答案[C]1992/二、1
6.等体积混和
0.10mol/L盐酸和0.06mol/LBa(OH)2溶液后,溶液的pH值等于
A.
2.0
B.1
2.3
C.
1.7
D.1
2.0答案[D]1999/1
8.用
0.1mol·L-1NaOH溶液滴定0.1mol·L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL),继续加水至50mL,所得溶液的pH是
A.4
B.
7.2
C.10
D.
1..3答案[C](2)根据溶液pH值求[H+]或[OH-]1988/二、
6.将pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混和后,溶液中的氢离子浓度最接近于 答案[D]1990/三、2
8.把80mLNaOH溶液加入到120mL盐酸中,所得溶液的pH值为2。如果混和前NaOH溶液和盐酸的摩尔浓度相同,它们的浓度是
A.
0.5mol/L
B.
0.1mol/L
C.
0.05mol/L
D.1mol/L答案[C](3)根据溶液的pH值求体积比199
8.18.PH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是
A.11∶1
B.9∶1
C.1∶11
D.1∶9答案[D](4)水的离子积Kw与pH值1989/
A.一、1
0.90℃时水的离子积Kw=
3.8×10-13,该温度时纯水的pH值
A.等于7
B.小于7
C.大于7
D.无法确定 答案[B]1991/五、3
6.在80℃时,纯水的pH值小于7,为什么?(答:已知室温时,纯水中的[H+]=[OH-]=10-7mol·L-1,又因水的离解(H2O=[OH-]>10-7mol·L-1,即pH<7。)(5)α与pH值的有关计算1997/2
3.若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为
A.10(a+b-12)%
B.10(a+b-14)%
C.10(12-a-b)%
D.10(14-a-b)% 答案[A](6)强酸与弱酸溶液中[H+]与pH值的关系1989/
A.二、1
4.pH值和体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下,放出二氧化碳气体的体积是
A.一样多
B.醋酸比硫酸多
C.硫酸比醋酸多
D.无法比较 答案[B](7)pH值与电离平衡移动的关系1989/
A.二、1
5.在1
0.mL0.1mol/L醋酸溶液中,欲使醋酸的电离度和溶液的pH值都增大,可以采用的方法是
A.加少量1mol/L氢氧化钠溶液
B.加少量1mol/L盐酸
C.加100mL水
D.加热 答案[A,C](8)pH试纸的使用1992/一、
5.用pH试纸测定某无色溶液的pH值时,规范的操作是
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 答案[C](9)电解后溶液pH值的变化规律1992/二、1
4.用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH值保持不变的是
A.HCl
B.NaOH
C.Na2SO4
D.NaCl 答案[C](10)酸碱盐溶液pH值大小的比较1991/3
5.浓度均为
0.1mol/L的8种溶液:①HNO3 ②H2SO4 ③HCOOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl,溶液pH值由小到大的顺序是:(填写编号)
题目解答
答案
答案②①③⑧⑦⑥⑤④
1992/三、24.相同温度、相同摩尔浓度的四种溶液:①CH3COONa、
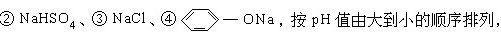
正确的是
| A.④>①>③>② | B.①>④>③>② |
|
C.①>②>③>④ | D.④>③>①>② | 答案[A] |
1993/11.摩尔浓度相等的下列溶液,pH值由大到小的顺序是
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.Na2CO3 NaCl NH4Cl NaHCO3
D.Na2CO3 NH4Cl NaHCO3 NaCl
答案[A]
1997/二、18.在室温下等体积的酸和碱的溶液,混合后pH值一定小于7的是
A.pH=3的硝酸跟pH=11的氢氧化钾溶液
B.pH=3的盐酸跟pH=11的氨水
C.pH=3的硫酸跟pH=11的氢氧化钠溶液
D.pH=3的醋酸跟pH=11的氢氧化钡溶液
答案[D]
(11)pH值变化的图像
1988/一、26.在室温下,向饱和H2S溶液中缓慢通入过量SO2气体,溶液的pH值随通入SO2体积的变化曲线示意图2-1-1,合理的是
答案[A]
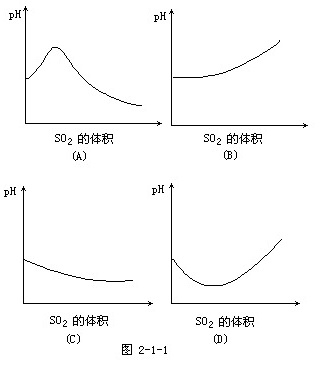
{ewc MVIMAGE,MVIMAGE, !262194T1.bmp}
(12)求pH值相同的两种强碱混合后溶液的pH值
1993/二、7.25mLpH=10的氢氧化钾溶液跟50mLpH=10的氢氧化钡溶液混和,混和液的pH值是
A.9.7 | B.10 | C.10.3 | D.10.7 | 答案[B] |
(13)将pH值引入有关离子组能否大量共存的题干中
1994/二、13.在pH=1的无色透明溶液中不能大量共存的离子组是
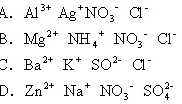
答案[A、C]
1995/二、11.在pH=1的溶液中,可以大量共存的离子组是
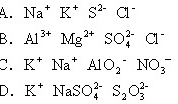
答案[B]
(14)弱酸的c,α,pH值的关系
1995/三、21.c1,c2,α1,α2,pH1,pH2分别表示2种一元弱酸的摩尔浓度、电离度和溶液的pH值。如果已知pH1<pH2,且α1>α2,则c1和c2的关系
A.c1>c2
B.c1=c2
C.c1<c2
D.无法确定
答案[D]
(15)将pH值引入离子浓度排队的题干中
1996/25.将pH=3的盐酸溶液和pH=11的氨水等体积混和后,溶液中离子浓度关系正确的是
A.[NH4+]>[Cl-]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[H+]>[OH-]
D.[Cl-]>[NH4+]>[OH-]>[H+]
答案[B]
(16)pH值与电解产物的有关计算
1991/三、25.用两支惰性电极插入500mLAgNO3溶液中通电电解。当电解液的pH值从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上应析出银的质量是
A.27mg | B.54mg |
|
C.108mg | D.216mg | 答案[B] |
(17)分析强酸溶液pH值与强碱溶液pH值之间的关系
1994/31.在25℃时,若10体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,则混和之前,该强酸的pH值与强碱的pH值之间应满足的关系是______。(答:强酸的pH值与强碱的pH值之和等于15。)