题目
CH4分子中碳原子的轨道杂化方式是() ()-|||-A.sp^1-|||-B.sp^2-|||-C.sp^3-|||-D.sp^4

题目解答
答案
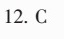
解析
考查要点:本题主要考查学生对杂化轨道理论的理解,特别是甲烷分子中碳原子的杂化方式判断。
解题核心思路:
- 确定中心原子的价层电子对数:包括成键电子对和孤对电子对。
- 根据价层电子对数判断杂化类型:
- 4对电子对(无孤对) → sp³杂化
- 3对电子对(无孤对) → sp²杂化
- 2对电子对(无孤对) → sp杂化
- 结合分子结构验证:甲烷分子为正四面体型结构,对应sp³杂化。
破题关键点:
- 碳原子在甲烷中形成4个C-H σ键,需通过2s轨道和3个2p轨道杂化生成4个sp³轨道。
- 无孤对电子,因此直接根据成键数判断杂化类型。
步骤1:分析碳原子的价层电子对数
- 碳原子的价电子数为4(2s²2p²)。
- 在甲烷中,碳与4个氢原子形成单键,共用4对电子,无孤对电子。
- 总电子对数 = 成键电子对数 + 孤对电子数 = 4 + 0 = 4。
步骤2:根据电子对数判断杂化类型
- 4对电子对对应sp³杂化(2s + 3个2p轨道混合生成4个sp³轨道)。
- sp³杂化轨道呈正四面体分布,键角约为109.5°,与甲烷分子结构一致。
结论:碳原子在CH₄中采用sp³杂化,对应选项C。