题目
12.理想气体反应 (H)_(3)OH(g)=!=!= HCHO(g)+(H)_(2)(g), 已知各物质在298K的热力学数据如下-|||-表所示:-|||-物质 (Delta )_(1)(H)_(m)^theta (298K)/(kJcdot (mol)^-1) _(n)_(n)_(n)_(n)_(n)_(n)_(n)_(n)_(n)_(n)_(n)_(n)_(n),m(298K)/(Jcdot (K)^-1cdot (mol)^-1)-|||-CH3OH(g) -201.2 20.4-|||-HCHO(g) -115.9 18.8-|||-H2(g) 0 29.1-|||-试计算:298K和600K时反应的标准摩尔焓变 Delta (H)^+

题目解答
答案
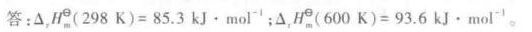
解析
考查要点:本题主要考查化学反应标准摩尔焓变的计算,涉及生成焓数据的应用和基尔霍夫定律的使用,需理解温度对焓变的影响。
解题核心思路:
- 计算298K时的焓变:直接利用各物质的生成焓(ΔfHmθ)代入反应式,通过生成物与反应物的焓差计算。
- 计算600K时的焓变:通过基尔霍夫定律,结合反应的热容变化(ΔCp)和温度差,对298K的焓变进行温度修正。
破题关键点:
- 正确写出反应的焓变公式:ΔH° = ΣΔfHmθ(生成物) − ΣΔfHmθ(反应物)。
- 准确计算反应的热容变化:ΔCp = ΣCp,mθ(生成物) − ΣCp,mθ(反应物)。
- 单位统一:注意热容单位从J到kJ的转换。
298K时的焓变计算
根据反应式:
$\text{CH}_3\text{OH(g)} \rightleftharpoons \text{HCHO(g)} + \text{H}_2\text{(g)}$
生成焓公式:
$\Delta_r H_m^\theta = \sum \Delta_f H_m^\theta (\text{生成物}) - \sum \Delta_f H_m^\theta (\text{反应物})$
代入数据:
$\Delta_r H_m^\theta (298\text{K}) = [(-115.9) + 0] - [(-201.2)] = 85.3 \, \text{kJ·mol}^{-1}$
600K时的焓变计算
基尔霍夫定律:
$\Delta H(T_2) = \Delta H(T_1) + \Delta C_p \cdot (T_2 - T_1)$
热容变化:
$\Delta C_p = [1 \cdot 18.8 + 1 \cdot 29.1] - [1 \cdot 20.4] = 27.5 \, \text{J·K}^{-1}\text{·mol}^{-1} = 0.0275 \, \text{kJ·K}^{-1}\text{·mol}^{-1}$
温度修正:
$\Delta H(600\text{K}) = 85.3 + 0.0275 \cdot (600 - 298) = 85.3 + 8.285 = 93.6 \, \text{kJ·mol}^{-1}$