题目
合成气(CO和H2)是重要的工业原料气。(1)合成气制备甲醇:CO(g)+2H2(g)=CH3OH(g)。CO的结构式为C≡O,估算该反应的ΔH需要 ____ (填数字)种化学键的键能数据。(2)合成气经“变换”“脱碳”获得纯H2。①合成气变换。向绝热反应器中通入CO、H2和过量的H2O(g):CO(g)+(H)_(2)O(g)underline(underline{低温型催化剂)} 约23(0)°C、3MPa H2 50 4-|||-个 个 40 a o {2-|||-三1三-|||-30-|||-20 l-|||-载氧体 载氧体 50 0-|||-一40 B-|||-反应器 z-|||-个 载氧体循环 20-|||-CH4 H2O 0 0.3 0.4 0.5 1.0-|||-步骤I 步骤Ⅱ x-|||-甲 乙③结合图示综合分析,步骤Ⅰ中Fe2O3的作用、气体分步制备的价值: ____ 。
合成气(CO和H2)是重要的工业原料气。
(1)合成气制备甲醇:CO(g)+2H2(g)=CH3OH(g)。CO的结构式为C≡O,估算该反应的ΔH需要 ____ (填数字)种化学键的键能数据。
(2)合成气经“变换”“脱碳”获得纯H2。
①合成气变换。向绝热反应器中通入CO、H2和过量的H2O(g):$CO(g)+{H}_{2}O(g)\begin{array}{c}\underline{\underline{低温型催化剂}}\\ 约23{0}°C、3MPa\end{array}C{O}_{2}(g)+{H}_{2}(g)\;\;ΔH<0$。催化作用受接触面积和温度等因素影响,H2O(g)的比热容较大。H2O(g)过量能有效防止催化剂活性下降,其原因有 ____ 。
②脱碳在钢制吸收塔中进行,吸收液成分:质量分数30%的K2CO3吸收剂、K2CrO4(Cr正价有+3、+6)缓蚀剂等。K2CO3溶液浓度偏高会堵塞设备,导致堵塞的物质是 ____ (填化学式)。K2CrO4减缓设备腐蚀的原理是 ____ 。
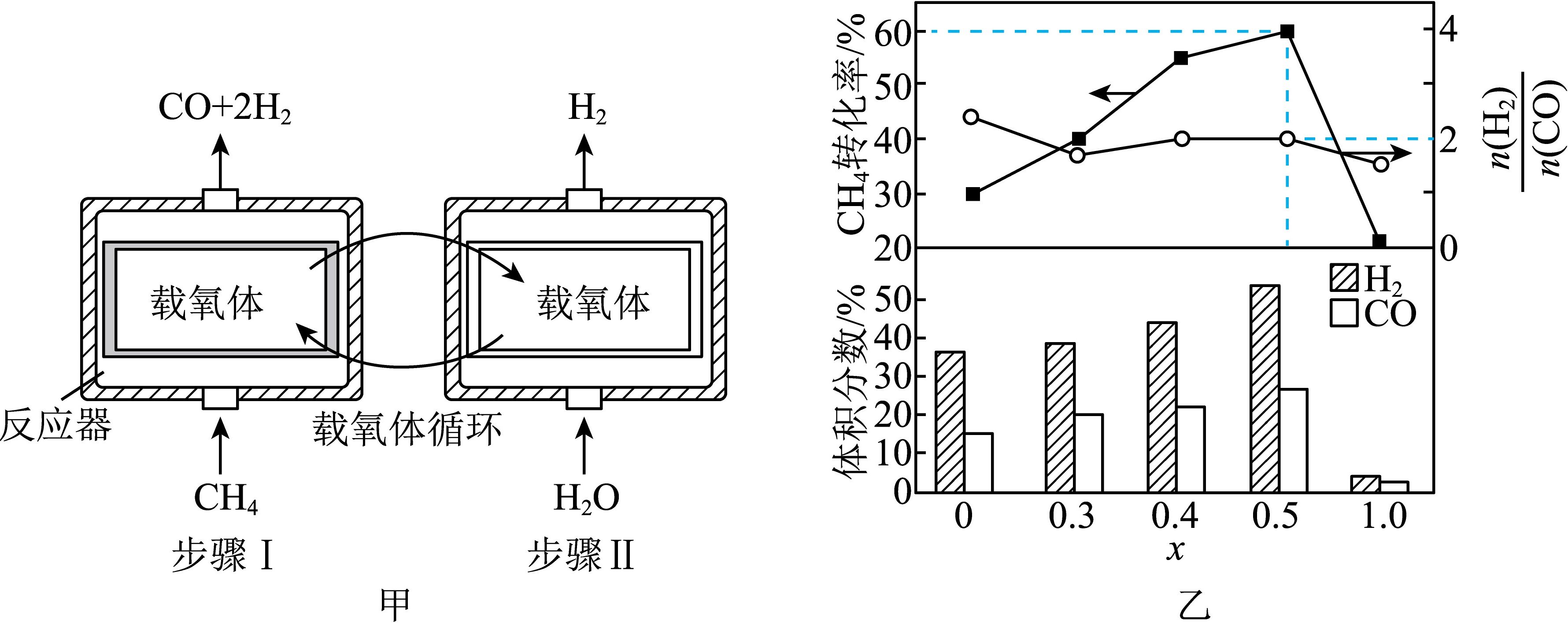
(3)研究CH4、H2O(g)与不同配比的铁铈载氧体[$\frac{x}{2}F{e}_{2}{O}_{3}•(1-x)Ce{O}_{2},0≤x≤1,Ce$是活泼金属,正价有+3、+4]反应,气体分步制备原理示意如图甲所示。相同条件下,先后以一定流速通入固定体积的CH4、H2O(g),依次发生的主要反应:
步骤Ⅰ$C{H}_{4}→_{850℃}^{载氧体供氧}CO+2{H}_{2}$
步骤Ⅱ${H}_{2}O→_{400℃}^{载氧体夺氧}{H}_{2}$
①步骤Ⅰ中,产物气体积分数、CH4转化率、$\frac{n({H}_{2})}{n(CO)}$与x的关系如图乙所示。x=0时,$\frac{n({H}_{2})}{n(CO)}$大于理论值2的可能原因有 ____ ;x=0.5时,通入标准状况下300mL的CH4至反应结束,CO的选择性=$\frac{{n}_{生成}(CO)}{{n}_{转化}(C{H}_{4})}×100%=80%$,则生成标准状况下CO和H2的总体积为 ____ mL。
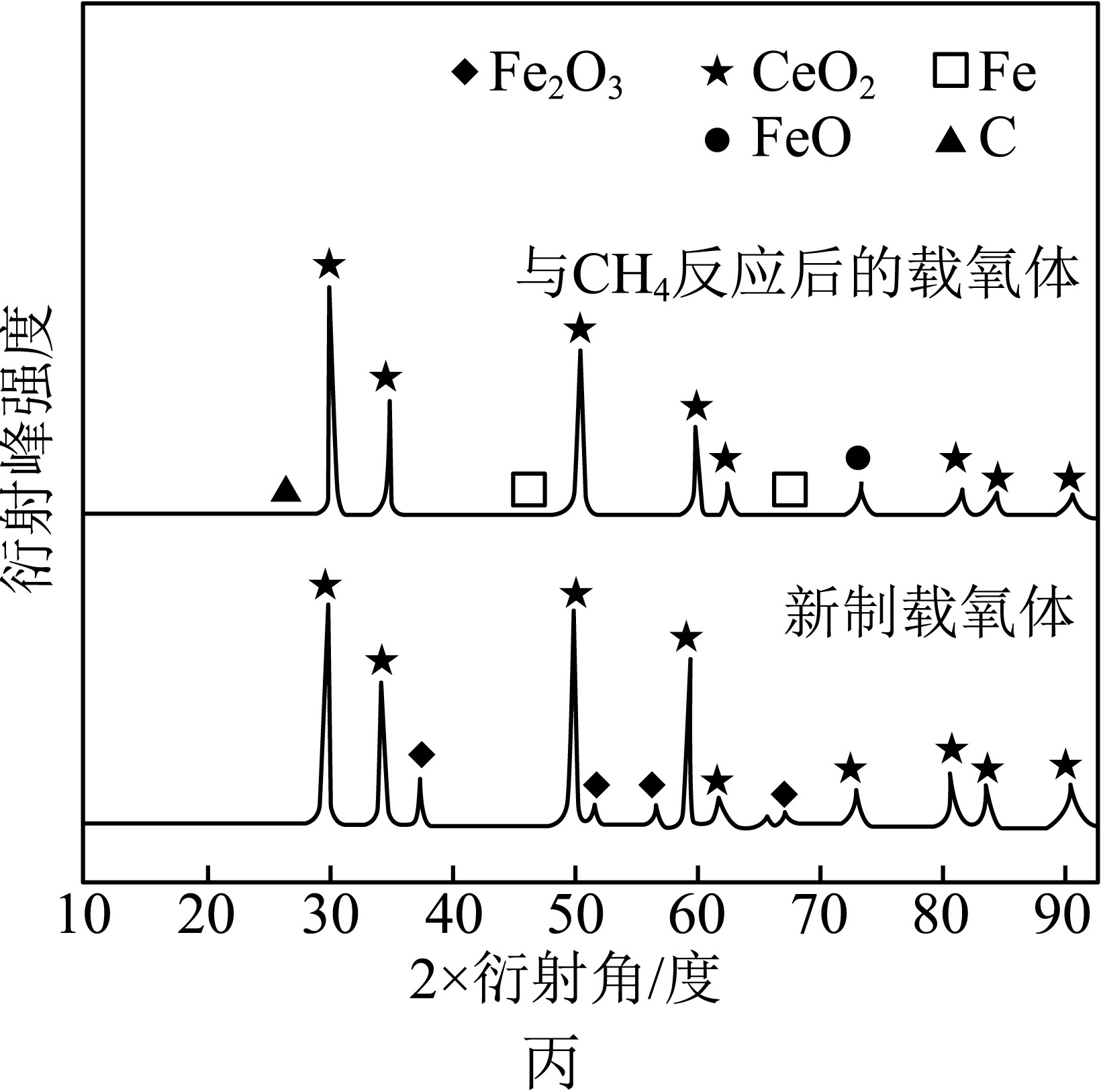
②x=0.5时,新制载氧体、与CH4反应后的载氧体的X射线衍射谱图如图丙所示(X射线衍射用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。步骤Ⅱ中,能与H2O(g)反应的物质有 ____ (填化学式)。
③结合图示综合分析,步骤Ⅰ中Fe2O3的作用、气体分步制备的价值: ____ 。
(1)合成气制备甲醇:CO(g)+2H2(g)=CH3OH(g)。CO的结构式为C≡O,估算该反应的ΔH需要 ____ (填数字)种化学键的键能数据。
(2)合成气经“变换”“脱碳”获得纯H2。
①合成气变换。向绝热反应器中通入CO、H2和过量的H2O(g):$CO(g)+{H}_{2}O(g)\begin{array}{c}\underline{\underline{低温型催化剂}}\\ 约23{0}°C、3MPa\end{array}C{O}_{2}(g)+{H}_{2}(g)\;\;ΔH<0$。催化作用受接触面积和温度等因素影响,H2O(g)的比热容较大。H2O(g)过量能有效防止催化剂活性下降,其原因有 ____ 。
②脱碳在钢制吸收塔中进行,吸收液成分:质量分数30%的K2CO3吸收剂、K2CrO4(Cr正价有+3、+6)缓蚀剂等。K2CO3溶液浓度偏高会堵塞设备,导致堵塞的物质是 ____ (填化学式)。K2CrO4减缓设备腐蚀的原理是 ____ 。
(3)研究CH4、H2O(g)与不同配比的铁铈载氧体[$\frac{x}{2}F{e}_{2}{O}_{3}•(1-x)Ce{O}_{2},0≤x≤1,Ce$是活泼金属,正价有+3、+4]反应,气体分步制备原理示意如图甲所示。相同条件下,先后以一定流速通入固定体积的CH4、H2O(g),依次发生的主要反应:
步骤Ⅰ$C{H}_{4}→_{850℃}^{载氧体供氧}CO+2{H}_{2}$
步骤Ⅱ${H}_{2}O→_{400℃}^{载氧体夺氧}{H}_{2}$
①步骤Ⅰ中,产物气体积分数、CH4转化率、$\frac{n({H}_{2})}{n(CO)}$与x的关系如图乙所示。x=0时,$\frac{n({H}_{2})}{n(CO)}$大于理论值2的可能原因有 ____ ;x=0.5时,通入标准状况下300mL的CH4至反应结束,CO的选择性=$\frac{{n}_{生成}(CO)}{{n}_{转化}(C{H}_{4})}×100%=80%$,则生成标准状况下CO和H2的总体积为 ____ mL。

②x=0.5时,新制载氧体、与CH4反应后的载氧体的X射线衍射谱图如图丙所示(X射线衍射用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。步骤Ⅱ中,能与H2O(g)反应的物质有 ____ (填化学式)。

③结合图示综合分析,步骤Ⅰ中Fe2O3的作用、气体分步制备的价值: ____ 。
题目解答
答案
(1)反应的焓变=反应物的总键能-生成物的总键能,计算该反应的ΔH需C≡O。H—H、C—O、C—H、O—H,共5种化学键的键能数据。
(2)①该反应为放热反应,在绝热容器中进行时,若无水的存在,随着反应进行,温度会逐渐升高,由于使用了低温型催化剂,温度过高会导致催化剂的活性下降;H2O(g)的比热容较大,可以吸收大量的热从而使体系温度变化较小,因此,H2O(g)过量可有效防止催化剂活性下降。
②脱碳过程中,K2CO3溶液会吸收CO2,发生反应K2CO3+CO2+H2O=2KHCO3,当K2CO3溶液浓度偏高时,会生成较多KHCO3,而KHCO3溶解度相对较小,容易在溶液中达到饱和后结晶析出,从而堵塞设备。K2CrO4中的Cr元素化合价为+6,处于最高价态,具有强氧化性,在钢制吸收塔的环境中,它会与铁发生氧化还原反应,使铁表面形成一层由铁的氧化物和铬的氧化物组成的致密氧化膜,这层氧化膜可以将钢铁与腐蚀性介质隔离开,阻止氧气、水和其他腐蚀性物质与钢铁接触,从而减缓腐蚀。
(3)①当x=0时,载氧体中没有Fe2O3,只有CeO2,由于CeO2的氧化性较强,且其提供的O原子较多,可以将CO氧化为CO2,使得CO的物质的量减小,$\frac{n({H}_{2})}{n(CO)}$增大;由题图乙可知,当x=0.5时,CH4转化率为60%,则n转化(CH4)=300mL×60%=180mL,已知CO的选择性=$\frac{{n}_{生成}(CO)}{{n}_{转化}(C{H}_{4})}×100%=80%$,则n生成(CO)=180mL×80%=144mL,根据图乙中数据可知,此时产物气中$\frac{n({H}_{2})}{n(CO)}=2$,则n生成(H2)=144mL×2=288mL,故生成标准状况下CO和H2的总体积为432mL。
②新制载氧体与CH4反应后新生成的晶态物质,在步骤Ⅱ中会与H2O(g)反应,使载氧体再生从而继续与CH4反应,因此,在新制载氧体中不存在,而在与CH4反应后的载氧体中含有的晶态物质,会在步骤Ⅱ中与H2O(g)反应。因此,对比二者X射线衍射谱图可知,C、Fe、FeO在步骤Ⅱ中均可与H2O(g)反应。
③步骤Ⅰ中Fe2O3作载氧体供氧,将甲烷转化为CO和氢气,可以避免生成大量积炭致催化剂活性降低甚至失活;采用分步制备,可提高原料利用率,且可以有效消除积碳使催化剂再生,同时步骤Ⅰ需要的温度较高,步骤Ⅱ需要的温度较低,分步制备也可节约能源。
(2)①该反应为放热反应,在绝热容器中进行时,若无水的存在,随着反应进行,温度会逐渐升高,由于使用了低温型催化剂,温度过高会导致催化剂的活性下降;H2O(g)的比热容较大,可以吸收大量的热从而使体系温度变化较小,因此,H2O(g)过量可有效防止催化剂活性下降。
②脱碳过程中,K2CO3溶液会吸收CO2,发生反应K2CO3+CO2+H2O=2KHCO3,当K2CO3溶液浓度偏高时,会生成较多KHCO3,而KHCO3溶解度相对较小,容易在溶液中达到饱和后结晶析出,从而堵塞设备。K2CrO4中的Cr元素化合价为+6,处于最高价态,具有强氧化性,在钢制吸收塔的环境中,它会与铁发生氧化还原反应,使铁表面形成一层由铁的氧化物和铬的氧化物组成的致密氧化膜,这层氧化膜可以将钢铁与腐蚀性介质隔离开,阻止氧气、水和其他腐蚀性物质与钢铁接触,从而减缓腐蚀。
(3)①当x=0时,载氧体中没有Fe2O3,只有CeO2,由于CeO2的氧化性较强,且其提供的O原子较多,可以将CO氧化为CO2,使得CO的物质的量减小,$\frac{n({H}_{2})}{n(CO)}$增大;由题图乙可知,当x=0.5时,CH4转化率为60%,则n转化(CH4)=300mL×60%=180mL,已知CO的选择性=$\frac{{n}_{生成}(CO)}{{n}_{转化}(C{H}_{4})}×100%=80%$,则n生成(CO)=180mL×80%=144mL,根据图乙中数据可知,此时产物气中$\frac{n({H}_{2})}{n(CO)}=2$,则n生成(H2)=144mL×2=288mL,故生成标准状况下CO和H2的总体积为432mL。
②新制载氧体与CH4反应后新生成的晶态物质,在步骤Ⅱ中会与H2O(g)反应,使载氧体再生从而继续与CH4反应,因此,在新制载氧体中不存在,而在与CH4反应后的载氧体中含有的晶态物质,会在步骤Ⅱ中与H2O(g)反应。因此,对比二者X射线衍射谱图可知,C、Fe、FeO在步骤Ⅱ中均可与H2O(g)反应。
③步骤Ⅰ中Fe2O3作载氧体供氧,将甲烷转化为CO和氢气,可以避免生成大量积炭致催化剂活性降低甚至失活;采用分步制备,可提高原料利用率,且可以有效消除积碳使催化剂再生,同时步骤Ⅰ需要的温度较高,步骤Ⅱ需要的温度较低,分步制备也可节约能源。