题目
氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。涉及反应如下:反应Ⅰ:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH1=-206.2kJ⋅mol-1反应Ⅱ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2反应Ⅲ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH3=-165.0kJ⋅mol-1回答下列问题:(1)ΔH2=-41.2kJ⋅mol-1。(2)已知反应Ⅱ的速率方程为v正=k正p(CO)⋅p(H2O),v逆=k逆p(CO2)⋅p(H2),其中k正、k逆分别为正、逆反应的速率常数。如图1(lgk表示速率常数的对数:(1)/(T)表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk逆随(1)/(T)变化关系的是斜线 d(填标号)。↑gg-|||-a-|||-b-|||-c-|||-d-|||-1/V1 1/T (K^(-1))-|||-图1-|||-100 1.0-|||-C(1,87.5)-|||-90 a 0.9-|||-Y X b-|||-70 0.7-|||-B(1,m) c-|||-50 Z W 0.5-|||-30 A(1,0.25)-|||-0.3-|||-d-|||-10 0.1-|||-n(H2)-|||-2-|||-n( 0)-|||-图2(3)温度T2时,在固定容积的容器中充入一定量的H2和1molCO,平衡时H2和CO的转化率(α)及CH4和CO2的物质的量(n)随(n((H)_(2)))/(n(CO))变化的情况如图2所示。①图中表示α(CO)、n(CH4)变化的曲线分别是 a、c(填标号);m=62.5;CH4的选择性[(n(C(H)_(4)))/(n(C(O)_{2))+n(C(H)_(4))}×100%]=60%。②已知起始充入1mol的CO和0.5mol的H2进行上述反应时,起始压强为1.5p0。反应Ⅰ的Kp=(64)/((p)_{0)^2}(用p0表示);温度T1,(n((H)_(2)))/(n(CO))=1时,α(CO)可能对应图中X、Y、Z、W四点中的 X(填标号)。
氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。涉及反应如下:
反应Ⅰ:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH1=-206.2kJ⋅mol-1
反应Ⅱ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2
反应Ⅲ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH3=-165.0kJ⋅mol-1
回答下列问题:
(1)ΔH2=
(2)已知反应Ⅱ的速率方程为v正=k正p(CO)⋅p(H2O),v逆=k逆p(CO2)⋅p(H2),其中k正、k逆分别为正、逆反应的速率常数。如图1(lgk表示速率常数的对数:$\frac{1}{T}$表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk逆随$\frac{1}{T}$变化关系的是斜线
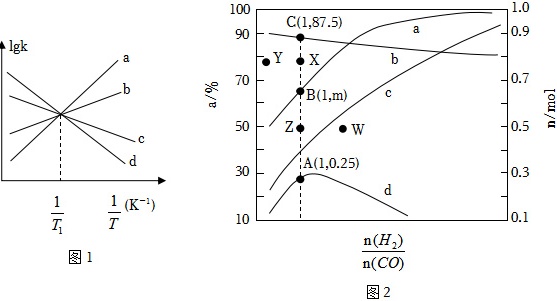
(3)温度T2时,在固定容积的容器中充入一定量的H2和1molCO,平衡时H2和CO的转化率(α)及CH4和CO2的物质的量(n)随$\frac{n({H}_{2})}{n(CO)}$变化的情况如图2所示。
①图中表示α(CO)、n(CH4)变化的曲线分别是
②已知起始充入1mol的CO和0.5mol的H2进行上述反应时,起始压强为1.5p0。反应Ⅰ的Kp=
反应Ⅰ:CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH1=-206.2kJ⋅mol-1
反应Ⅱ:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2
反应Ⅲ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH3=-165.0kJ⋅mol-1
回答下列问题:
(1)ΔH2=
-41.2
kJ⋅mol-1。(2)已知反应Ⅱ的速率方程为v正=k正p(CO)⋅p(H2O),v逆=k逆p(CO2)⋅p(H2),其中k正、k逆分别为正、逆反应的速率常数。如图1(lgk表示速率常数的对数:$\frac{1}{T}$表示温度的倒数)所示a、b、c、d四条斜线中,能表示lgk逆随$\frac{1}{T}$变化关系的是斜线
d
(填标号)。
(3)温度T2时,在固定容积的容器中充入一定量的H2和1molCO,平衡时H2和CO的转化率(α)及CH4和CO2的物质的量(n)随$\frac{n({H}_{2})}{n(CO)}$变化的情况如图2所示。
①图中表示α(CO)、n(CH4)变化的曲线分别是
a
、c
(填标号);m=62.5
;CH4的选择性$[\frac{n(C{H}_{4})}{n(C{O}_{2})+n(C{H}_{4})}×100%]$=60%
。②已知起始充入1mol的CO和0.5mol的H2进行上述反应时,起始压强为1.5p0。反应Ⅰ的Kp=
$\frac{64}{{p}_{0}^{2}}$
(用p0表示);温度T1,$\frac{n({H}_{2})}{n(CO)}$=1时,α(CO)可能对应图中X、Y、Z、W四点中的 X
(填标号)。题目解答
答案
解:(1)根据盖斯定律,反应Ⅱ=反应Ⅰ-反应Ⅲ,则ΔH2=ΔH1-ΔH3=(-206.2kJ/mol)-(-165.0kJ/mol)=-41.2kJ/mol,
故答案为:-41.2;
(2)反应Ⅱ为放热反应,随温度的升高正、逆反应速率都增大,k正、k逆都增大,但k逆增大的倍数大于k正增大的倍数,故能表示lgk逆随$\frac{1}{T}$变化关系的是斜线d,
故答案为:d;
(3)①随$\frac{n({H}_{2})}{n(CO)}$的增大,CO的平衡转化率增大、H2的平衡转化率减小,则平衡时CH4物质的量一定大于CO2物质的量,平衡时CH4与CO2物质的量之和等于转化的CO物质的量,故a表示CO的平衡转化率,b表示H2的平衡转化率,c表示CH4平衡物质的量,d表示CO2平衡物质的量;由图可知$\frac{n({H}_{2})}{n(CO)}$=1时,CO和H2起始物质的量都为1mol,H2的平衡转化率为87.5%,转化H2物质的量为0.875mol,则CO的平衡转化率为m%,转化CO物质的量为m%mol,平衡时CO2为0.25mol,平衡时CH4物质的量为(m%-0.25)mol,根据H守恒,平衡时H2O的物质的量为0.875mol-2×(m%-0.25)mol=(1.375-2m%)mol,根据O守恒,m%mol=(1.375-2m%)mol+0.25mol×2,解得m=62.5,即平衡时CO的平衡转化率为62.5%;平衡时CH4物质的量为(0.625-0.25)mol=0.375mol,CH4的选择性为$\frac{0.375mol}{0.375mol+0.25mol}×100%$=60%,
故答案为:a;c;62.5;60%;
②由于Kp只与温度有关,温度T2时,起始压强为1.5p0,充入1mol的CO和0.5mol的H2进行上述反应时,则CO的分压为p0、H2的分压为0.5p0;若起始充入1mol的CO和1mol的H2,则平衡时CO、H2、CH4、H2O(g)、CO2物质的量依次为0.375mol、0.125mol、0.375mol、0.125mol、0.25mol,则平衡时CO、H2、CH4、H2O(g)、CO2的分压依次为0.375p0、0.125 p0、0.375 p0、0.125 p0、0.25 p0,反应Ⅰ的Kp=$\frac{0.375{p}_{0}×0.125{p}_{0}}{0.375{p}_{0}×(0.125{p}_{0})^{3}}$=$\frac{64}{{p}_{0}^{2}}$;反应Ⅱ的Kp=$\frac{0.25{p}_{0}×0.125{p}_{0}}{0.375{p}_{0}×0.125{p}_{0}}$=$\frac{2}{3}$;温度T1时,反应Ⅱ的k正=k逆,T1时反应Ⅱ的Kp=$\frac{{k}_{正}}{{k}_{逆}}$=1>$\frac{2}{3}$,由于反应Ⅱ为放热反应,升高温度,反应Ⅱ的Kp减小,故T1<T2;降低温度,反应Ⅰ、Ⅱ都正向移动,CO的平衡转化率增大,故温度T1、$\frac{n({H}_{2})}{n(CO)}$=1时α(CO)可能对应图中X点,
故答案为:$\frac{64}{{p}_{0}^{2}}$;X。
故答案为:-41.2;
(2)反应Ⅱ为放热反应,随温度的升高正、逆反应速率都增大,k正、k逆都增大,但k逆增大的倍数大于k正增大的倍数,故能表示lgk逆随$\frac{1}{T}$变化关系的是斜线d,
故答案为:d;
(3)①随$\frac{n({H}_{2})}{n(CO)}$的增大,CO的平衡转化率增大、H2的平衡转化率减小,则平衡时CH4物质的量一定大于CO2物质的量,平衡时CH4与CO2物质的量之和等于转化的CO物质的量,故a表示CO的平衡转化率,b表示H2的平衡转化率,c表示CH4平衡物质的量,d表示CO2平衡物质的量;由图可知$\frac{n({H}_{2})}{n(CO)}$=1时,CO和H2起始物质的量都为1mol,H2的平衡转化率为87.5%,转化H2物质的量为0.875mol,则CO的平衡转化率为m%,转化CO物质的量为m%mol,平衡时CO2为0.25mol,平衡时CH4物质的量为(m%-0.25)mol,根据H守恒,平衡时H2O的物质的量为0.875mol-2×(m%-0.25)mol=(1.375-2m%)mol,根据O守恒,m%mol=(1.375-2m%)mol+0.25mol×2,解得m=62.5,即平衡时CO的平衡转化率为62.5%;平衡时CH4物质的量为(0.625-0.25)mol=0.375mol,CH4的选择性为$\frac{0.375mol}{0.375mol+0.25mol}×100%$=60%,
故答案为:a;c;62.5;60%;
②由于Kp只与温度有关,温度T2时,起始压强为1.5p0,充入1mol的CO和0.5mol的H2进行上述反应时,则CO的分压为p0、H2的分压为0.5p0;若起始充入1mol的CO和1mol的H2,则平衡时CO、H2、CH4、H2O(g)、CO2物质的量依次为0.375mol、0.125mol、0.375mol、0.125mol、0.25mol,则平衡时CO、H2、CH4、H2O(g)、CO2的分压依次为0.375p0、0.125 p0、0.375 p0、0.125 p0、0.25 p0,反应Ⅰ的Kp=$\frac{0.375{p}_{0}×0.125{p}_{0}}{0.375{p}_{0}×(0.125{p}_{0})^{3}}$=$\frac{64}{{p}_{0}^{2}}$;反应Ⅱ的Kp=$\frac{0.25{p}_{0}×0.125{p}_{0}}{0.375{p}_{0}×0.125{p}_{0}}$=$\frac{2}{3}$;温度T1时,反应Ⅱ的k正=k逆,T1时反应Ⅱ的Kp=$\frac{{k}_{正}}{{k}_{逆}}$=1>$\frac{2}{3}$,由于反应Ⅱ为放热反应,升高温度,反应Ⅱ的Kp减小,故T1<T2;降低温度,反应Ⅰ、Ⅱ都正向移动,CO的平衡转化率增大,故温度T1、$\frac{n({H}_{2})}{n(CO)}$=1时α(CO)可能对应图中X点,
故答案为:$\frac{64}{{p}_{0}^{2}}$;X。