题目
↑沉淀质量 sqrt (8)-|||-5.27 A B 注明:-|||-Ob段表示滴加硝酸钡溶液;-|||-bd段表示滴加稀硝酸。-|||-2.33 C D-|||-0 a b c d 实验过程某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有Na+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、(CO)_(3)^2-、(SO)_(4)^2-、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol•L-1的硝酸,实验过程中沉淀质量的变化情况如图所示:(1)水样中一定含有的阴离子是 ____ ,其物质的量浓度之比为 ____ 。(2)写出BC段所表示反应的离子方程式: ____ 。(3)由B到C点变化过程中消耗硝酸的体积为 ____ 。(4)试根据实验结果推测Na+是否存在? ____ (填“是”或“否”);若存在,Na+的物质的量浓度c(Na+)的范围是 ____ (若Na+不存在,则不必回答该问)。(5)设计简单实验验证原水样中可能存在的离子: ____ 。(写出实验步骤、现象和结论)
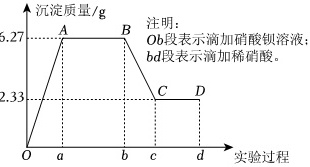 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有Na+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、${CO}_{3}^{2-}$、${SO}_{4}^{2-}$、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol•L-1的硝酸,实验过程中沉淀质量的变化情况如图所示:
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有Na+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、${CO}_{3}^{2-}$、${SO}_{4}^{2-}$、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加1mol•L-1的硝酸,实验过程中沉淀质量的变化情况如图所示:(1)水样中一定含有的阴离子是 ____ ,其物质的量浓度之比为 ____ 。
(2)写出BC段所表示反应的离子方程式: ____ 。
(3)由B到C点变化过程中消耗硝酸的体积为 ____ 。
(4)试根据实验结果推测Na+是否存在? ____ (填“是”或“否”);若存在,Na+的物质的量浓度c(Na+)的范围是 ____ (若Na+不存在,则不必回答该问)。
(5)设计简单实验验证原水样中可能存在的离子: ____ 。(写出实验步骤、现象和结论)
题目解答
答案
解:该水样为无色溶液,水样Fe3+、Cu2+不存在,依据图象分析加入硝酸钡溶液生成沉淀,加入稀硝酸,沉淀部分溶解证明水样中一定含有${SO}_{4}^{2-}$,${CO}_{3}^{2-}$,又因为Al3+与${CO}_{3}^{2-}$发生双水解,${CO}_{3}^{2-}$与Ag+、Ca2+、Mg2+发生反应生成沉淀不能大量存在,所以Al3+、Ag+、Ca2+、Mg2+不存在;n(${SO}_{4}^{2-}$)=$\frac{2.33g}{233g/mol}$=0.01mol,n(${CO}_{3}^{2-}$)=n(BaCO3)=$\frac{6.27g-2.32g}{197g/mol}$=0.02mol;c(${SO}_{4}^{2-}$):c(${CO}_{3}^{2-}$)=1:2;原溶液中可能含有Cl-,依据电解质溶液中电荷守恒,阳离子K+一定存在;根据电荷守恒得到:0.01mol×2+0.02mol×2+n(Cl-)=n(K+)推知n(K+)≥0.06mol,则c(K+)≥0.06mol/L;
(1)水样中一定含有的阴离子是${SO}_{4}^{2-}$,${CO}_{3}^{2-}$;其物质的量浓度之比为1:2;
故答案为:${SO}_{4}^{2-}$,${CO}_{3}^{2-}$;1:2;
(2)BC段所表示反应是碳酸钡溶于稀硝酸的反应,反应的离子方程式:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)由B到C点变化过程中依据图象分析得到的碳酸钡n(BaCO3)=$\frac{6.27g-2.33g}{197g/mol}$=0.02mol;消耗稀硝酸物质的量为0.04mol,消耗硝酸的体积=$\frac{n}{c}$=$\frac{0.04mol}{1mol/L}$=0.04L=40ml,
故答案为:40ml;
(4)依据电解质溶液中电荷守恒,阳离子K+一定存在;根据电荷守恒得到:0.01mol×2+0.02mol×2+n(Cl-)=n(K+)推知n(K+)≥0.06mol,则c(K+)≥0.6mol/L,
故答案为:是;≥0.6mol/L;
(5)可能存在的离子是Cl-,实验设计为:取少量水样与试管中,向试管中加入过量的硝酸钡溶液和稀硝酸,待沉淀完全和无气体生成后,向上层清液中滴加适量的硝酸银溶液,若生成白色沉淀,则原水样中 含有Cl-,若无白色沉淀生成,证明无Cl-存在,
故答案为:取少量水样与试管中,向试管中加入过量升温硝酸钡溶液和稀硝酸,待沉淀完全和无气体生成后,向上层清液中滴加适量的硝酸银溶液,若生成白色沉淀,则原水样中 含有Cl-,若无白色沉淀生成,证明无Cl-存在。
(1)水样中一定含有的阴离子是${SO}_{4}^{2-}$,${CO}_{3}^{2-}$;其物质的量浓度之比为1:2;
故答案为:${SO}_{4}^{2-}$,${CO}_{3}^{2-}$;1:2;
(2)BC段所表示反应是碳酸钡溶于稀硝酸的反应,反应的离子方程式:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)由B到C点变化过程中依据图象分析得到的碳酸钡n(BaCO3)=$\frac{6.27g-2.33g}{197g/mol}$=0.02mol;消耗稀硝酸物质的量为0.04mol,消耗硝酸的体积=$\frac{n}{c}$=$\frac{0.04mol}{1mol/L}$=0.04L=40ml,
故答案为:40ml;
(4)依据电解质溶液中电荷守恒,阳离子K+一定存在;根据电荷守恒得到:0.01mol×2+0.02mol×2+n(Cl-)=n(K+)推知n(K+)≥0.06mol,则c(K+)≥0.6mol/L,
故答案为:是;≥0.6mol/L;
(5)可能存在的离子是Cl-,实验设计为:取少量水样与试管中,向试管中加入过量的硝酸钡溶液和稀硝酸,待沉淀完全和无气体生成后,向上层清液中滴加适量的硝酸银溶液,若生成白色沉淀,则原水样中 含有Cl-,若无白色沉淀生成,证明无Cl-存在,
故答案为:取少量水样与试管中,向试管中加入过量升温硝酸钡溶液和稀硝酸,待沉淀完全和无气体生成后,向上层清液中滴加适量的硝酸银溶液,若生成白色沉淀,则原水样中 含有Cl-,若无白色沉淀生成,证明无Cl-存在。