某工厂的工业废水中含有大量的rm FeSO_4和较多的rm Cu^2+。为了减少污染并变废为宝,工厂计划从该废水中回收rm FeSO_4和金属铜。请根据以下流程图,回答下列问题。加入试剂-|||-⑦-|||-③-|||-①-|||-工 加入试剂 ⑧-|||-⑤ 操作方法 ④-|||-业-|||-废-|||-水 操作方法 FeSO4·7H 2O-|||-⑥-|||-②-|||-冷却结晶(1)填写下列标号所代表的物质(主要成分的化学式,注意用量)或操作方法:①_____;②_____;③_____;④_____;⑤_____;⑥_____;⑦_____;⑧_____。(2)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是_____,现象依次是_____;请写出该鉴别过程中属于氧化还原反应的离子方程式:_____。(3)若取rm 2 mL溶液④加入试管中,然后滴加氢氧化钠,产生的现象是______;此过程涉及反应的化学方程式是_____。
某工厂的工业废水中含有大量的$$\rm FeSO_4$$和较多的$$\rm Cu^{2+}$$。为了减少污染并变废为宝,工厂计划从该废水中回收$$\rm FeSO_4$$和金属铜。请根据以下流程图,回答下列问题。
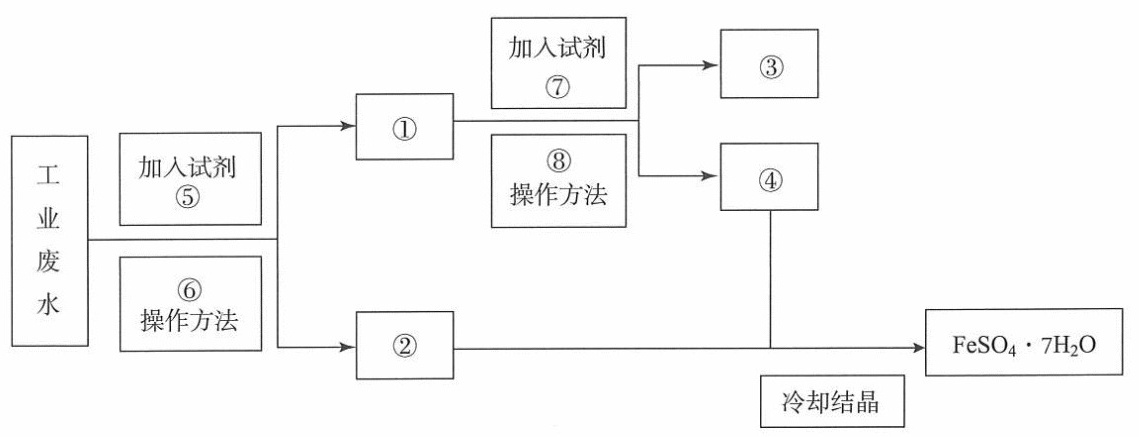
(1)填写下列标号所代表的物质(主要成分的化学式,注意用量)或操作方法:
①_____;②_____;③_____;④_____;⑤_____;⑥_____;⑦_____;⑧_____。
(2)鉴别溶液④中的金属阳离子时,应滴加的试剂依次是_____,现象依次是_____;请写出该鉴别过程中属于氧化还原反应的离子方程式:_____。
(3)若取$$\rm 2\ mL$$溶液④加入试管中,然后滴加氢氧化钠,产生的现象是______;此过程涉及反应的化学方程式是_____。
题目解答
答案
(1)$$\mathrm{Fe}、\mathrm{Cu}$$;$$\mathrm{F}\mathrm{e}{\mathrm{SO}}_{4}$$;$$\rm \mathrm{Cu}$$;$${\mathrm{FeSO}}_{4}$$;过量铁粉;过滤;适量稀硫酸;过滤
(2)$$\mathrm{KSCN}$$溶液,氯水;滴加$$\mathrm{KSCN}$$溶液,无现象,再滴加氯水,溶液变红;$$2{\mathrm{Fe}}^{2+}+{\mathrm{Cl}}_{2}=2{\mathrm{Fe}}^{3+}+2{\mathrm{Cl}}^{-}$$
(3)先生成白色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色;$${\mathrm{FeSO}}_{4}+2\mathrm{NaOH}=\mathrm{Fe}{\left(\mathrm{OH}\right)}_{2}\downarrow +{\mathrm{Na}}_{2}{\mathrm{SO}}_{4}$$、$$4\mathrm{Fe}{\left(\mathrm{OH}\right)}_{2}+{\mathrm{O}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}=4\mathrm{Fe}{\left(\mathrm{OH}\right)}_{3}$$
解析
加入过量的铁粉,将$$\rm Cu^{2+}$$还原为$$\rm Cu$$,同时生成$$\rm FeSO_4$$。
步骤 2:过滤
过滤后,得到的固体为$$\rm Fe$$和$$\rm Cu$$的混合物。
步骤 3:加入适量稀硫酸
加入适量的稀硫酸,可以将$$\rm Fe$$溶解,得到$$\rm FeSO_4$$溶液。
步骤 4:过滤
过滤后,得到的固体为$$\rm Cu$$。
步骤 5:冷却结晶
将$$\rm FeSO_4$$溶液冷却结晶,得到$$\rm FeSO_4·7H_2O$$。
步骤 6:鉴别溶液④中的金属阳离子
鉴别溶液④中的金属阳离子时,应滴加的试剂依次是$$\mathrm{KSCN}$$溶液,氯水;现象依次是滴加$$\mathrm{KSCN}$$溶液,无现象,再滴加氯水,溶液变红。
步骤 7:氧化还原反应的离子方程式
该鉴别过程中属于氧化还原反应的离子方程式为$$2{\mathrm{Fe}}^{2+}+{\mathrm{Cl}}_{2}=2{\mathrm{Fe}}^{3+}+2{\mathrm{Cl}}^{-}$$。
步骤 8:滴加氢氧化钠
若取$$\rm 2\ mL$$溶液④加入试管中,然后滴加氢氧化钠,产生的现象是先生成白色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色。
步骤 9:涉及反应的化学方程式
此过程涉及反应的化学方程式是$${\mathrm{FeSO}}_{4}+2\mathrm{NaOH}=\mathrm{Fe}{\left(\mathrm{OH}\right)}_{2}\downarrow +{\mathrm{Na}}_{2}{\mathrm{SO}}_{4}$$、$$4\mathrm{Fe}{\left(\mathrm{OH}\right)}_{2}+{\mathrm{O}}_{2}+2{\mathrm{H}}_{2}\mathrm{O}=4\mathrm{Fe}{\left(\mathrm{OH}\right)}_{3}$$。