题目
LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如图:硫酸 MnO2石灰乳 BaS 碳酸锂CO2和O2-|||-A-|||-能锰矿 - 反应器 调approx 7 分离器 电解槽 MnO2 煅烧窑 LiMn2O4-|||-滤渣 电解废液已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。回答下列问题:(1)硫酸溶矿主要反应的化学方程式为 ____ 。为提高溶矿速率,可采取的措施 ____ (举1例)。(2)加入少量MnO2的作用是 ____ 。不宜使用H2O2替代MnO2,原因是 ____ 。(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)= ____ mol•L-1;用石灰乳调节至pH≈7,除去的金属离子是 ____ 。(4)加入少量BaS溶液除去Ni2+,生成的沉淀有 ____ 。(5)煅烧窑中,生成LiMn2O4反应的化学方程式是 ____ 。
LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如图:
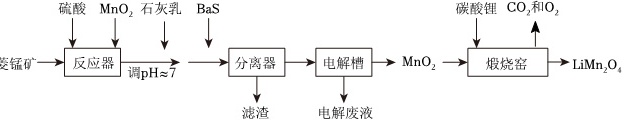
已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为 ____ 。为提高溶矿速率,可采取的措施 ____ (举1例)。
(2)加入少量MnO2的作用是 ____ 。不宜使用H2O2替代MnO2,原因是 ____ 。
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)= ____ mol•L-1;用石灰乳调节至pH≈7,除去的金属离子是 ____ 。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有 ____ 。
(5)煅烧窑中,生成LiMn2O4反应的化学方程式是 ____ 。

已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.3×10-33,Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为 ____ 。为提高溶矿速率,可采取的措施 ____ (举1例)。
(2)加入少量MnO2的作用是 ____ 。不宜使用H2O2替代MnO2,原因是 ____ 。
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)= ____ mol•L-1;用石灰乳调节至pH≈7,除去的金属离子是 ____ 。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有 ____ 。
(5)煅烧窑中,生成LiMn2O4反应的化学方程式是 ____ 。
题目解答
答案
解:(1)硫酸溶矿过程中,MnCO3和稀硫酸反应生成硫酸锰、二氧化碳、水,主要反应的化学方程式为MnCO3+H2SO4=MnSO4+H2O+CO2↑;根据影响反应速率的因素,粉碎菱锰矿、适当升高温度、适当增大硫酸浓度都能提高溶矿速率,
故答案为:MnCO3+H2SO4=MnSO4+H2O+CO2↑;粉碎菱锰矿;
(2)MnO2具有氧化性,加入少量MnO2的作用是将Fe2+氧化为Fe3+。Fe3+可以催化H2O2分解,所以不宜使用H2O2替代MnO2,
故答案为:将Fe2+氧化为Fe3+;Fe3+可以催化H2O2分解;
(3)溶矿反应完成后,反应器中溶液pH=4,c(OH-)=1×10-10,此时c(Fe3+)=$\frac{2.8×1{0}^{-39}}{{(1×1{0}^{-10})}^{3}}=2.8×1{0}^{-9}$ mol•L-1;Ksp[Al(OH)3]=1.3×10-33,用石灰乳调节至pH≈7,c(Al3+)=$\frac{1.3×1{0}^{-33}}{{(1×1{0}^{-7})}^{3}}=1.3×1{0}^{-12}$,Al3+完全转化为氢氧化铝沉淀,除去的金属离子是Al3+,
故答案为:2.8×10-9;Al3+;
(4)加入少量BaS溶液除去Ni2+,可知生成的沉淀有BaSO4、NiS,
故答案为:BaSO4、NiS;
(5)根据流程图,煅烧窑中碳酸锂、二氧化锰反应生成LiMn2O4、二氧化碳、氧气,反应的化学方程式是2Li2CO3+8MnO2$\frac{\underline{煅烧}}{\;}$4LiMn2O4+2CO2↑+O2↑,
故答案为:2Li2CO3+8MnO2$\frac{\underline{煅烧}}{\;}$4LiMn2O4+2CO2↑+O2↑。
故答案为:MnCO3+H2SO4=MnSO4+H2O+CO2↑;粉碎菱锰矿;
(2)MnO2具有氧化性,加入少量MnO2的作用是将Fe2+氧化为Fe3+。Fe3+可以催化H2O2分解,所以不宜使用H2O2替代MnO2,
故答案为:将Fe2+氧化为Fe3+;Fe3+可以催化H2O2分解;
(3)溶矿反应完成后,反应器中溶液pH=4,c(OH-)=1×10-10,此时c(Fe3+)=$\frac{2.8×1{0}^{-39}}{{(1×1{0}^{-10})}^{3}}=2.8×1{0}^{-9}$ mol•L-1;Ksp[Al(OH)3]=1.3×10-33,用石灰乳调节至pH≈7,c(Al3+)=$\frac{1.3×1{0}^{-33}}{{(1×1{0}^{-7})}^{3}}=1.3×1{0}^{-12}$,Al3+完全转化为氢氧化铝沉淀,除去的金属离子是Al3+,
故答案为:2.8×10-9;Al3+;
(4)加入少量BaS溶液除去Ni2+,可知生成的沉淀有BaSO4、NiS,
故答案为:BaSO4、NiS;
(5)根据流程图,煅烧窑中碳酸锂、二氧化锰反应生成LiMn2O4、二氧化碳、氧气,反应的化学方程式是2Li2CO3+8MnO2$\frac{\underline{煅烧}}{\;}$4LiMn2O4+2CO2↑+O2↑,
故答案为:2Li2CO3+8MnO2$\frac{\underline{煅烧}}{\;}$4LiMn2O4+2CO2↑+O2↑。
解析
步骤 1:硫酸溶矿反应
硫酸溶矿过程中,菱锰矿中的MnCO_3与硫酸反应生成硫酸锰、二氧化碳和水。
步骤 2:提高溶矿速率
提高溶矿速率的方法包括粉碎菱锰矿、适当升高温度、适当增大硫酸浓度等。
步骤 3:MnO_2的作用
MnO_2具有氧化性,可以将Fe^{2+}氧化为Fe^{3+},便于后续沉淀除去。
步骤 4:Fe^{3+}浓度计算
根据溶矿反应后溶液的pH值,计算Fe^{3+}的浓度。
步骤 5:调节pH值
用石灰乳调节pH值至7,使Al^{3+}沉淀除去。
步骤 6:BaS的作用
加入BaS溶液,与Ni^{2+}反应生成沉淀,除去Ni^{2+}。
步骤 7:煅烧窑反应
在煅烧窑中,碳酸锂和二氧化锰反应生成LiMn_2O_4、二氧化碳和氧气。
硫酸溶矿过程中,菱锰矿中的MnCO_3与硫酸反应生成硫酸锰、二氧化碳和水。
步骤 2:提高溶矿速率
提高溶矿速率的方法包括粉碎菱锰矿、适当升高温度、适当增大硫酸浓度等。
步骤 3:MnO_2的作用
MnO_2具有氧化性,可以将Fe^{2+}氧化为Fe^{3+},便于后续沉淀除去。
步骤 4:Fe^{3+}浓度计算
根据溶矿反应后溶液的pH值,计算Fe^{3+}的浓度。
步骤 5:调节pH值
用石灰乳调节pH值至7,使Al^{3+}沉淀除去。
步骤 6:BaS的作用
加入BaS溶液,与Ni^{2+}反应生成沉淀,除去Ni^{2+}。
步骤 7:煅烧窑反应
在煅烧窑中,碳酸锂和二氧化锰反应生成LiMn_2O_4、二氧化碳和氧气。