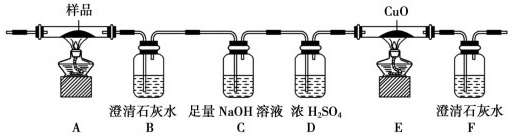
锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣已知氢氧化锶在水中的溶解度:温度(℃)10203040608090100溶解度(g/100mL)0.911.251.772.643.958.4220.244.591.2(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为_____________。____________(写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有_____种。19、实验室制备叔丁基苯(焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣)的反应和有关数据如下:焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣+ClC(CH3)3焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣 焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣+HCl焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣I.如图是实验室制备无水AlCl3,可能需要的装置:焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣(1)检查B装置气密性的方法是_______。(2)制备无水AlCl3的装置依次合理的连接顺序为__________(埴小写字母),其中E装置的作用是________。(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,其原因是________。Ⅱ.如图是实验室制备叔丁基苯的装置(夹持装置略):在三颈烧瓶中加入50 mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。(4)使用恒压漏斗的优点是_______;加入无水MgSO4固体的作用是________。焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣(5)洗涤混合物时所用的试剂有如下三种,正确的顺序是________。(填序号)①5%的Na2CO3溶液 ②稀盐酸 ③H2O(6)本实验中叔丁基苯的产率为______。(保留3位有效数字)20、草酸及其盐是重要的化工原料,其中最常用的是三草酸合铁酸钾和草酸钴,已知草酸钴不溶于水,三草酸合铁酸钾晶体(焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣)易溶于水,难溶于乙醇。这两种草酸盐受热均可发生分解等反应,反应及气体产物检验装置如图。焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣(l)草酸钴晶体(焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣)在200℃左右可完全失去结晶水。用以上装置在空气中加热5. 49 g草酸钴晶体(焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。焦炭 盐酸-|||-天青石 - 焙烧 酸浸 除杂 → 趁热过滤|→-→Sr(OH )2产品-|||-CO 脱硫 滤渣实验过程中观察到只有B中澄清石灰水明显变浑浊,E中始终没有红色固体生成。根据实验结果,290 - 320℃过程中发生反应的化学方程式是____;设置D的作用是____。(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=___。②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,请写出吸收时的离子方程式______;再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3溶液。请写出电解时阳极的电极反应:____。.
锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下:
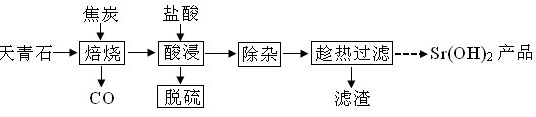
已知氢氧化锶在水中的溶解度:
温度(℃)
10
20
30
40
60
80
90
100
溶解度(g/100mL)
0.91
1.25
1.77
2.64
3.95
8.42
20.2
44.5
91.2
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为_____________。
____________(写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有_____种。
19、实验室制备叔丁基苯(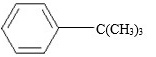 )的反应和有关数据如下:
)的反应和有关数据如下:
 +ClC(CH3)3
+ClC(CH3)3
 +HCl
+HCl
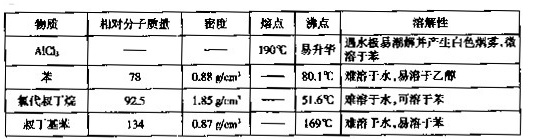
I.如图是实验室制备无水AlCl3,可能需要的装置:
(1)检查B装置气密性的方法是_______。
(2)制备无水AlCl3的装置依次合理的连接顺序为__________(埴小写字母),其中E装置的作用是________。
(3)实验时应先加热圆底烧瓶再加热硬质玻璃管,其原因是________。
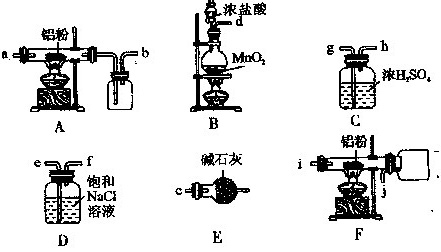
Ⅱ.如图是实验室制备叔丁基苯的装置(夹持装置略):
在三颈烧瓶中加入50 mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(4)使用恒压漏斗的优点是_______;加入无水MgSO4固体的作用是________。
(5)洗涤混合物时所用的试剂有如下三种,正确的顺序是________。(填序号)
①5%的Na2CO3溶液 ②稀盐酸 ③H2O
(6)本实验中叔丁基苯的产率为______。(保留3位有效数字)
20、草酸及其盐是重要的化工原料,其中最常用的是三草酸合铁酸钾和草酸钴,已知草酸钴不溶于水,三草酸合铁酸钾晶体( )易溶于水,难溶于乙醇。这两种草酸盐受热均可发生分解等反应,反应及气体产物检验装置如图。
)易溶于水,难溶于乙醇。这两种草酸盐受热均可发生分解等反应,反应及气体产物检验装置如图。
(l)草酸钴晶体(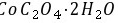 )在200℃左右可完全失去结晶水。用以上装置在空气中加热5. 49 g草酸钴晶体(
)在200℃左右可完全失去结晶水。用以上装置在空气中加热5. 49 g草酸钴晶体(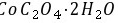 )样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
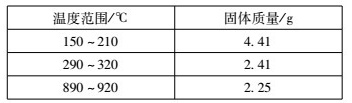
实验过程中观察到只有B中澄清石灰水明显变浑浊,E中始终没有红色固体生成。根据实验结果,290 - 320℃过程中发生反应的化学方程式是____;设置D的作用是____。
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=___。
②若pH过大,将导致氢氧化锶的产率降低,请解释原因____。
(3)“趁热过滤”的目的是____,“滤渣”的主要成分为___。
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为____、过滤、洗涤、干燥。
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,请写出吸收时的离子方程式______;再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3溶液。请写出电解时阳极的电极反应:____。
.题目解答
答案
对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应(i):2CH4(g)+O2(g)2CO(g)+4H2(g) △H=-71.4kJ•mol1、
反应(ii):CH4(g)+CO2(g)2CO(g)+2H2(g) △H=+247.0 kJ•mol1、
(1)写出表示CO燃烧热的热化学方程式:_______________________________。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应(ii):CH4(g)+CO2(g)2CO(g)+2H2(g) (不发生其它反应),CO2的平衡转化率如下表所示:
容器 | 起始物质的量(n) / mol | CO2的 平衡转化率 | |||
CH4 | CO2 | CO | H2 | ||
Ⅰ | 0.1 | 0.1 | 50% | ||
Ⅱ | 0.1 | 0.1 | 0.2 | 0.2 | / |
①下列能说明反应达到平衡状态是_________。
A.v正(CH4) =2v逆(CO)
B.容器内各物质的浓度满足c(CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的总压强不再变化
D.容器内混合气体密度保持不变
②若容器Ⅰ内反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:v(H2) = ________(用含t的表达式表示)。
(6)根据题目所给数据,结合KAl(SO4)2▪12H2O的化学式,可验证出第一个阶段应是脱掉结晶水得到KAl(SO4)2;第二阶段脱掉SO3,发生的是非氧化还原反应,得到K2SO4和Al2O3;
答案:KAl(SO4)2▪12H2OKAl(SO4)2+12H2O 2KAl(SO4)2K2SO4+Al2O3+3SO3↑
21、SrSO4+4CSrS+4CO↑ 1.2×101、0 mol•L1、 OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出 防止温度降低使氢氧化锶析出而造成损失 Ca(OH)2、Mg(OH)2 降温结晶 2Fe3++H2S=2Fe2++S↓+2H+ Fe2+—e—=Fe3+
.