题目
某一化学反应,在298K和标准压力下进行,当反应进度为1mol时,放热40.0 kJ。若使反应通过可逆电池来完成,反应程度相同,则吸热4.0 kJ。(1)计算反应进度为1mol时的熵变。(2)当反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,从隔离系统的总熵变值说明了什么问题?(3)计算系统可能做的最大功的值。
某一化学反应,在298K和标准压力下进行,当反应进度为1mol时,放热40.0 kJ。若使反应通过可逆电池来完成,反应程度相同,则吸热4.0 kJ。(1)计算反应进度为1mol时的熵变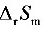 。(2)当反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,从隔离系统的总熵变值说明了什么问题?(3)计算系统可能做的最大功的值。
。(2)当反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,从隔离系统的总熵变值说明了什么问题?(3)计算系统可能做的最大功的值。
题目解答
答案
解:(1) 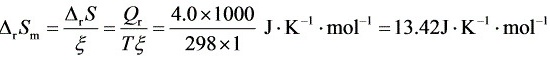
(2) 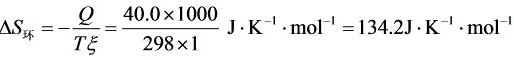
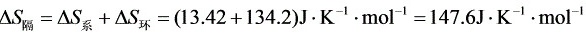
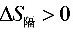 ,说明该过程能自发进行。
,说明该过程能自发进行。
(3) 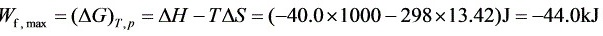
解析
步骤 1:计算反应进度为1mol时的熵变△rSm
根据热力学第一定律,反应的焓变(ΔH)和熵变(ΔS)与反应的吉布斯自由能变(ΔG)之间的关系为:ΔG = ΔH - TΔS。当反应通过可逆电池完成时,系统所做的最大功等于ΔG。因此,我们可以利用ΔG = ΔH - TΔS来计算熵变ΔS。
步骤 2:计算环境的熵变
当反应不通过可逆电池完成时,环境的熵变可以通过热量与温度的比值来计算,即ΔS_环境 = -Q/T,其中Q为系统与环境交换的热量,T为温度。
步骤 3:计算隔离系统的总熵变
隔离系统的总熵变等于系统熵变与环境熵变之和,即ΔS_总 = ΔS_系统 + ΔS_环境。
步骤 4:计算系统可能做的最大功
系统可能做的最大功等于吉布斯自由能变ΔG,即W_max = ΔG。
根据热力学第一定律,反应的焓变(ΔH)和熵变(ΔS)与反应的吉布斯自由能变(ΔG)之间的关系为:ΔG = ΔH - TΔS。当反应通过可逆电池完成时,系统所做的最大功等于ΔG。因此,我们可以利用ΔG = ΔH - TΔS来计算熵变ΔS。
步骤 2:计算环境的熵变
当反应不通过可逆电池完成时,环境的熵变可以通过热量与温度的比值来计算,即ΔS_环境 = -Q/T,其中Q为系统与环境交换的热量,T为温度。
步骤 3:计算隔离系统的总熵变
隔离系统的总熵变等于系统熵变与环境熵变之和,即ΔS_总 = ΔS_系统 + ΔS_环境。
步骤 4:计算系统可能做的最大功
系统可能做的最大功等于吉布斯自由能变ΔG,即W_max = ΔG。