题目
称取混和碱试样0.6524 g,以酚酞为指示剂,用0.1992 mol·L-1 HCl标准溶液滴定至终点,用去酸溶液21.76 mL。再加甲基橙指示剂,滴定至终点,又耗去酸溶液27.15 mL。求试样中各组分的质量分数。(相对分子质量Na2CO3=106.0,NaHCO3=84.00,NaOH=40.00)
称取混和碱试样0.6524 g,以酚酞为指示剂,用0.1992 mol·L-1 HCl标准溶液滴定至终点,用去酸溶液21.76 mL。再加甲基橙指示剂,滴定至终点,又耗去酸溶液27.15 mL。求试样中各组分的质量分数。(相对分子质量Na2CO3=106.0,NaHCO3=84.00,NaOH=40.00)
题目解答
答案
解:由于V1<V2,故可判断混合碱试样组成为Na2CO3和NaHCO3;
Na2CO3 + 2HCl = 2NaCl + H 2O + CO2 ↑
NaHCO3 +HCl =NaCl +H 2O +CO2 ↑
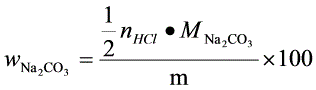 %
%
 =
=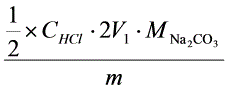 ×100%
×100%
 =
=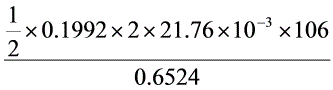 ×100% = 70.42%
×100% = 70.42%
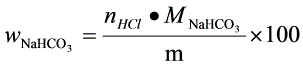 %
%
 =
=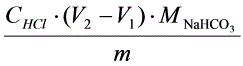 ×100%
×100%
 =
=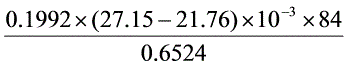 ×100%
×100% = 13.82%
= 13.82%
答:试样含Na2CO3 35.21%;含NaHCO3 13.82%
解析
步骤 1:确定混合碱的组成
由于V1步骤 2:计算Na2CO3的质量分数
Na2CO3与HCl反应的化学方程式为:Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑
根据反应方程式,Na2CO3与HCl的摩尔比为1:2,因此Na2CO3的质量分数计算公式为:
${W}_{{Na}_{2}C{O}_{3}}=\dfrac {\dfrac {1}{2}{n}_{HCl}\cdot {M}_{{Na}_{2}C{O}_{3}}{m}\times 100$%
步骤 3:计算NaHCO3的质量分数
NaHCO3与HCl反应的化学方程式为:NaHCO3 + HCl = NaCl + H2O + CO2 ↑
根据反应方程式,NaHCO3与HCl的摩尔比为1:1,因此NaHCO3的质量分数计算公式为:
${W}_{NaHC{O}_{3}}=\dfrac {{n}_{HCl}\cdot {M}_{NaHC{O}_{3}}{m}\times 100$%
由于V1
Na2CO3与HCl反应的化学方程式为:Na2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑
根据反应方程式,Na2CO3与HCl的摩尔比为1:2,因此Na2CO3的质量分数计算公式为:
${W}_{{Na}_{2}C{O}_{3}}=\dfrac {\dfrac {1}{2}{n}_{HCl}\cdot {M}_{{Na}_{2}C{O}_{3}}{m}\times 100$%
步骤 3:计算NaHCO3的质量分数
NaHCO3与HCl反应的化学方程式为:NaHCO3 + HCl = NaCl + H2O + CO2 ↑
根据反应方程式,NaHCO3与HCl的摩尔比为1:1,因此NaHCO3的质量分数计算公式为:
${W}_{NaHC{O}_{3}}=\dfrac {{n}_{HCl}\cdot {M}_{NaHC{O}_{3}}{m}\times 100$%