釜式反应器3.1在等温间歇反应器中进行乙酸乙酯皂化反应:该反应对乙酸乙酯及氢氧化钠均为一级。反应开始时乙酸乙酯及氢氧化钠的浓度均为0.02mol/l,反应速率常数等于5.6l/mol.min。要求最终转化率达到95%。试问:(1)(1)当反应器的反应体积为1m3时,需要多长的反应时间?(2)(3)(2)若反应器的反应体积为2m3,,所需的反应时间又是多少?(4)
釜式反应器
3.1在等温间歇反应器中进行乙酸乙酯皂化反应:
该反应对乙酸乙酯及氢氧化钠均为一级。反应开始时乙酸乙酯及氢氧化钠的浓度均为0.02mol/l,反应速率常数等于5.6l/mol.min。要求最终转化率达到95%。试问:
(1)(1)当反应器的反应体积为1m3时,需要多长的反应时间?
(2)
(3)(2)若反应器的反应体积为2m3,,所需的反应时间又是多少?
(4)
题目解答
答案
解:(1)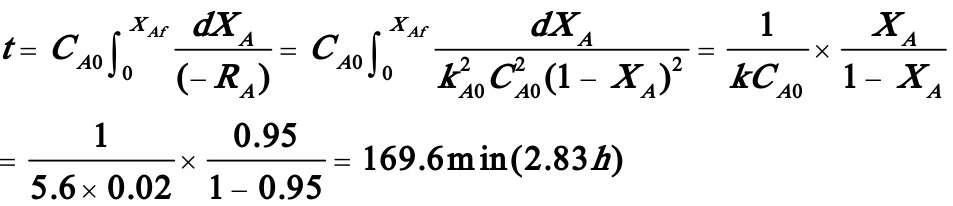
(2) 因为间歇反应器的反应时间与反应器的大小无关,所以反应时间仍为2.83h。
3.2拟在等温间歇反应器中进行氯乙醇的皂化反应:
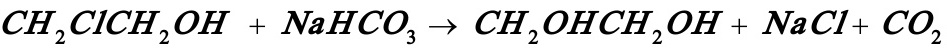
以生产乙二醇,产量为20㎏/h,使用15%(重量)的NaHCO3水溶液及30%(重量)的氯乙醇水溶液作原料,反应器装料中氯乙醇和碳酸氢钠的摩尔比为1:1,混合液的比重为1.02。该反应对氯乙醇和碳酸氢钠均为一级,在反应温度下反应速率常数等于5.2l/mol.h,要求转化率达到95%。
(1)(1)若辅助时间为0.5h,试计算反应器的有效体积;
(2)(2)若装填系数取0.75,试计算反应器的实际体积。
解:氯乙醇,碳酸氢钠,和乙二醇的分子量分别为80.5,84 和 62kg/kmol,每小时产乙二醇:20/62=0.3226 kmol/h
每小时需氯乙醇: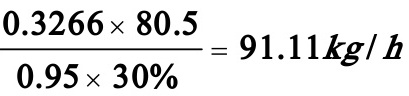
每小时需碳酸氢钠: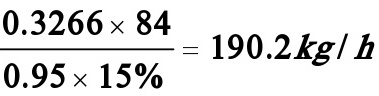
原料体积流量: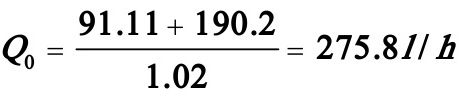
氯乙醇初始浓度: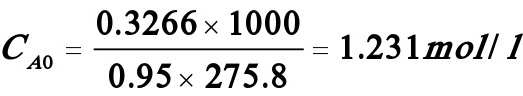
反应时间:
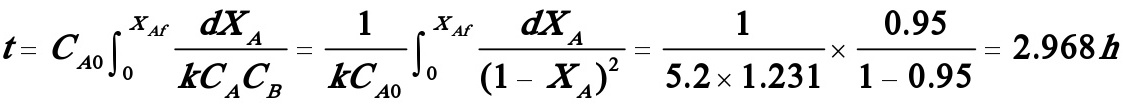
反应体积: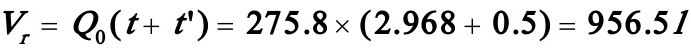
(2)(2)反应器的实际体积: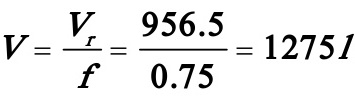
3.3丙酸钠与盐酸的反应:

为二级可逆反应(对丙酸钠和盐酸均为一级),在实验室中用间歇反应器于50℃等温下进行该反应的实验。反应开始时两反应物的摩尔比为1,为了确定反应进行的程度,在不同的反应时间下取出10ml反应液用0.515N的NaOH溶液滴定,以确定未反应盐酸浓度。不同反应时间下,NaOH溶液用量如下表所示:
时间,min | 10 | 20 | 30 | 50 | ∝ | |
NaOH用量,ml | 52.2 | 32.1 | 23.5 | 18.9 | 14.4 | 10.5 |
现拟用与实验室反应条件相同的间歇反应器生产丙酸,产量为500kg/h,且丙酸钠的转化率要达到平衡转化率的90%。试计算反应器的反应体积。假定(1)原料装入以及加热至反应温度(50℃)所需的时间为20min,且在加热过程中不进行反应;(2)卸料及清洗时间为10min;(3)反应过程中反应物密度恒定。
解:用A,B,R,S分别表示反应方程式中的四种物质,利用当量关系可求出任一时刻盐酸的浓度(也就是丙酸钠的浓度,因为其计量比和投量比均为1:1)为:
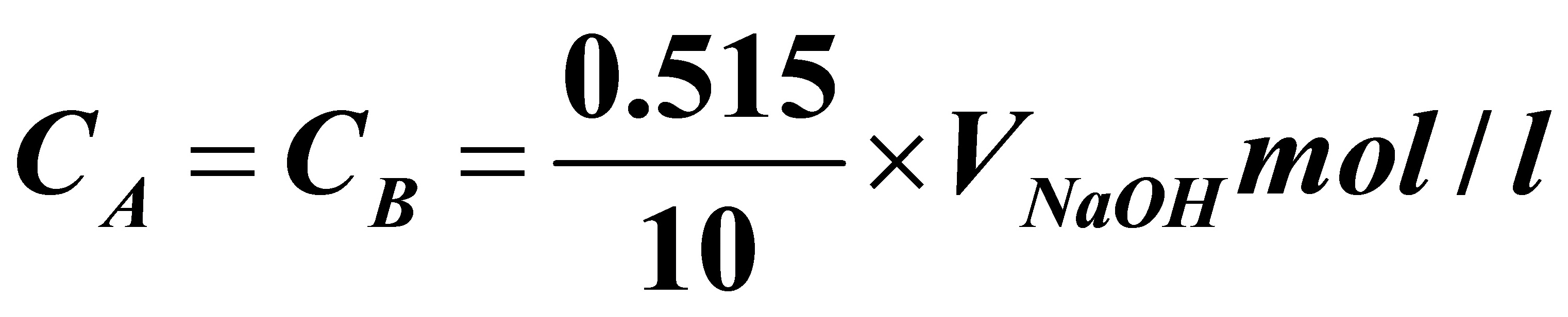
于是可求出A的平衡转化率:
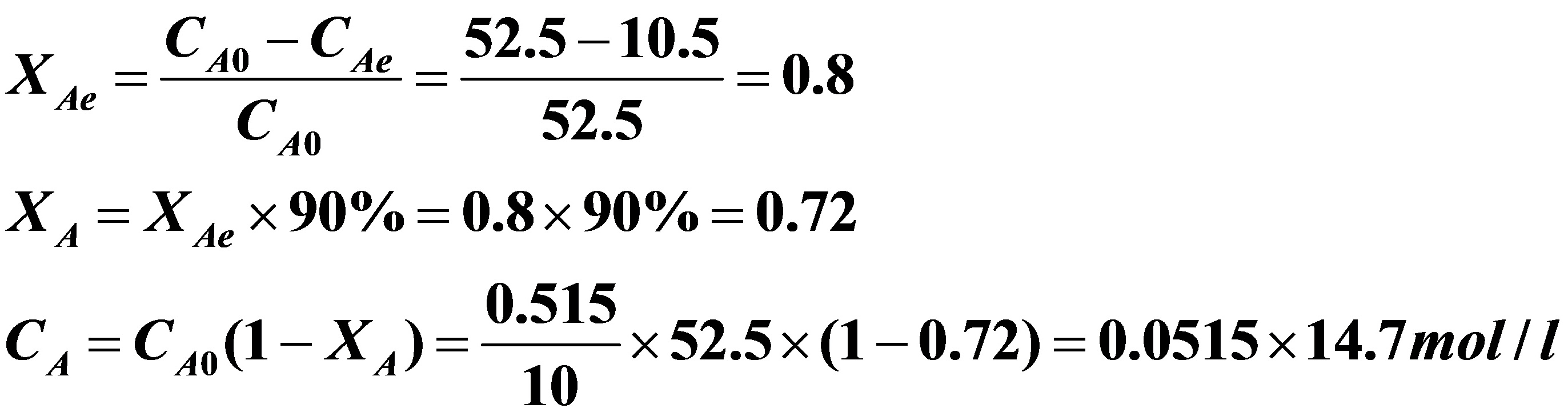
现以丙酸浓度对时间作图:
由上图,当CA=0.0515×14.7mol/l时,所对应的反应时间为48min。由于在同样条件下,间歇反应器的反应时间与反应器的大小无关,所以该生产规模反应器的反应时间也是48min。
丙酸的产量为:500kg/h=112.6mol/min。
所需丙酸钠的量为:112.6/0.72=156.4mol/min。
原料处理量为: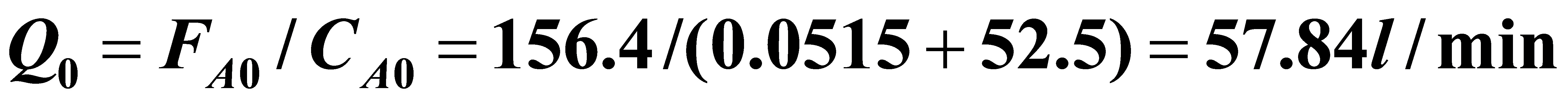
反应器体积: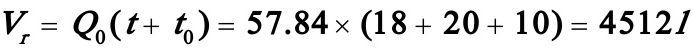
实际反应体积: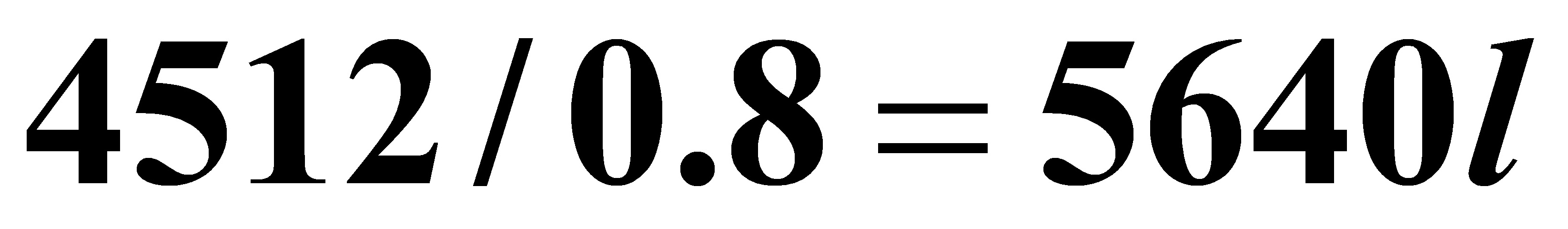
3.4在间歇反应器中,在绝热条件下进行液相反应:
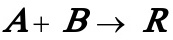
其反应速率方程为: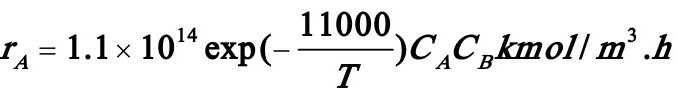
式中组分A及B的浓度CA及CB以kmol/m3为单位,温度T的单位为K。该反应的热效应等于-4000kJ/kmol。反应开始时溶液不含R,组分A和B的浓度均等于0.04kmol/m3,反应混合物的平均热容按4.102kJ/m3.K计算。反应开始时反应混合物的温度为50℃。
(1)(1)试计算A的转化率达85%时所需的反应时间及此时的反应温度。
(2)(2)如果要求全部反应物都转化为产物R,是否可能为什么
解:(1)
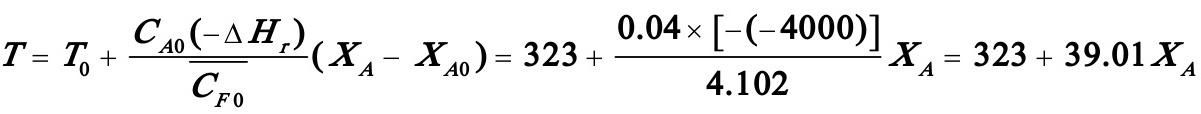
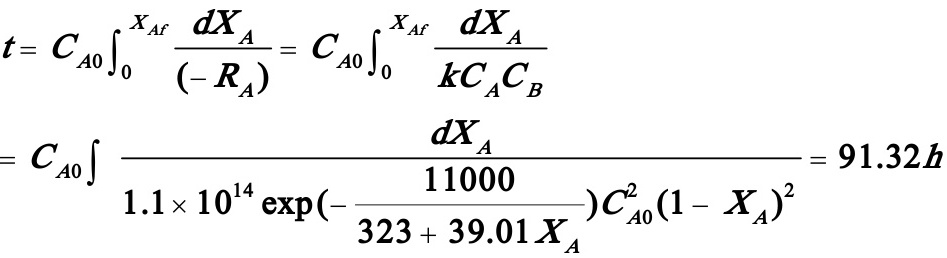
(由数值积分得出)
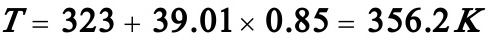
(2)若A全部转化为R,即XA=1.0,则由上面的积分式知,t→∝,这显然是不可能的。
3.5在间歇反应器中进行液相反应:
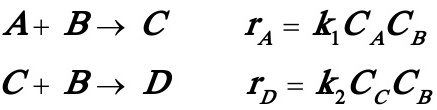
A的初始浓度为0.1kmol/m3,C,D的初始浓度为零,B过量,反应时间为t1时,CA=0.055kmol/m3,CC=0.038 kmol/m3,而反应时间为t2时,CA=0.01 kmol/m3,CC=0.042kmol/m3,试求:
(1)(1)k2/k1;
(2)(2)产物C的最大浓度;
(3)(3)对应C的最大浓度时A的转化率。
解:(1)因为B过量,所以:
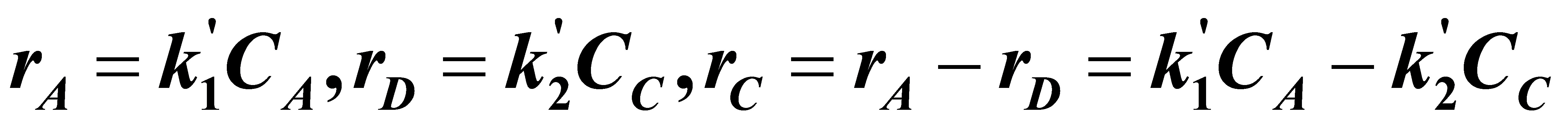
恒容时:
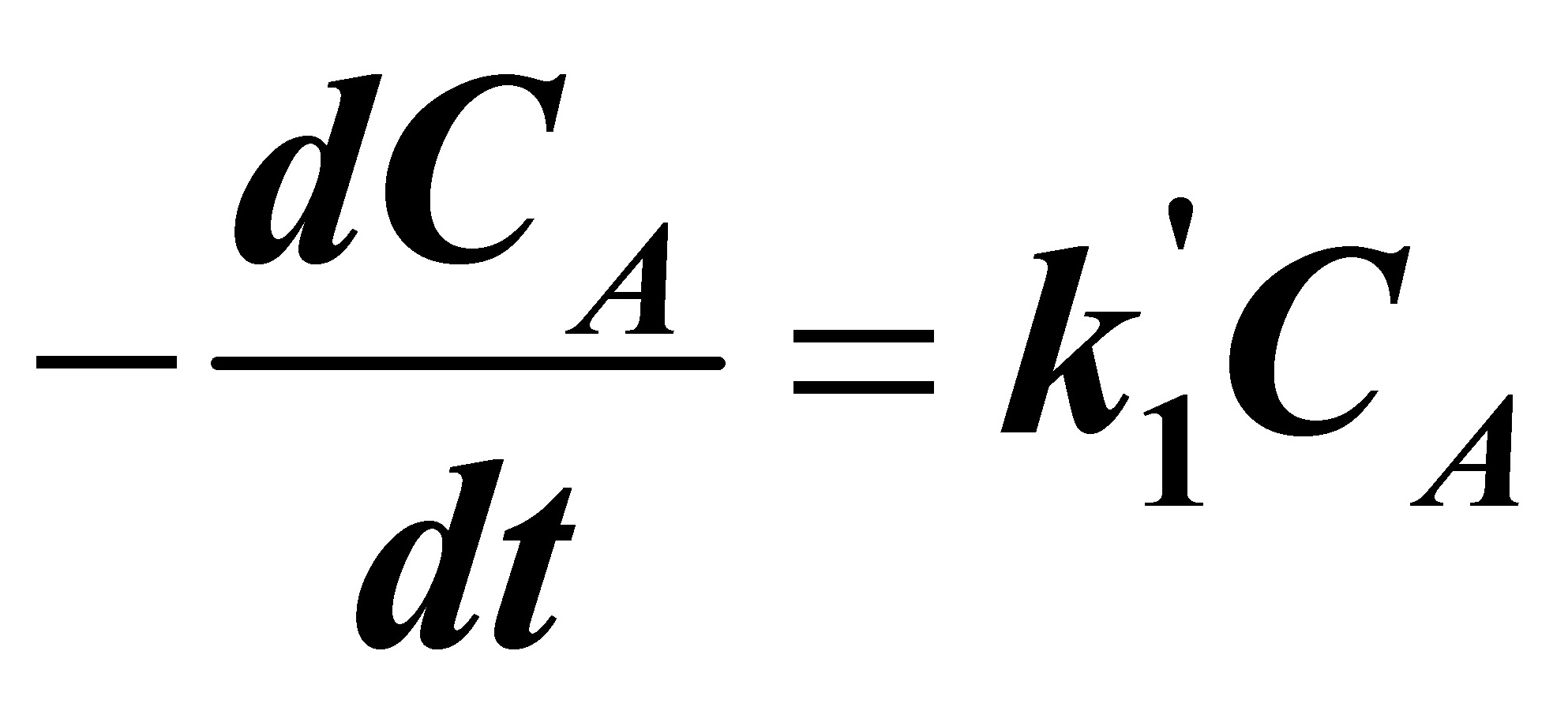 (A)
(A)
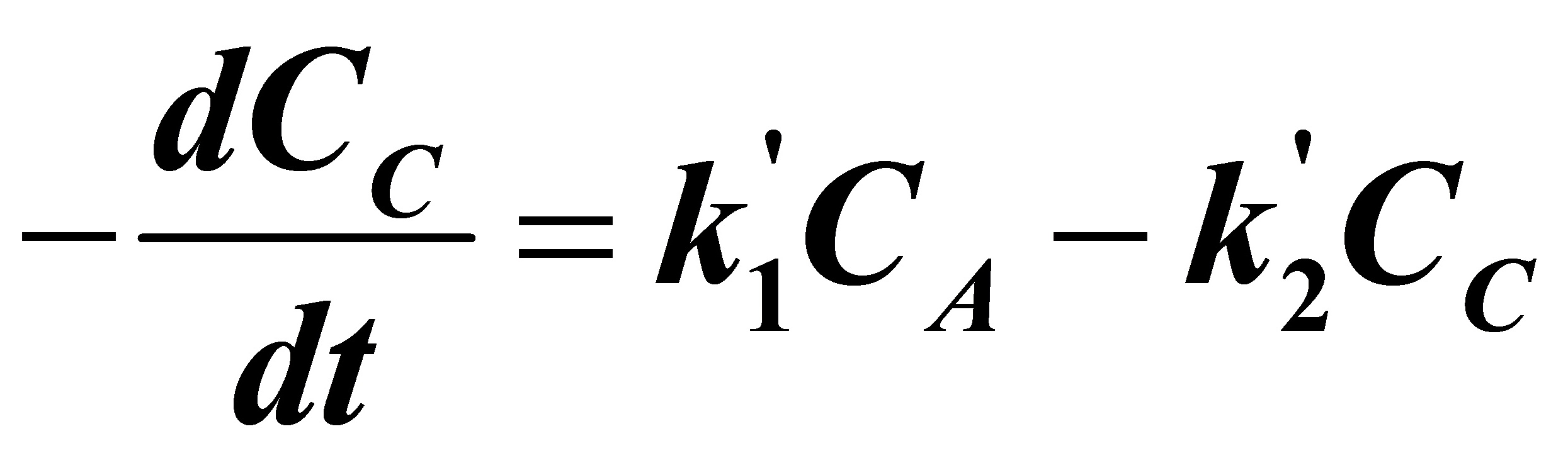 (B)
(B)
(B)式除以(A)式得:
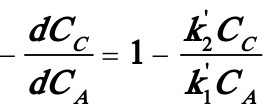
解此微分方程得:
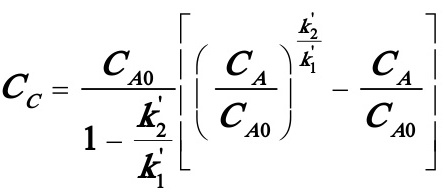 (C)
(C)
将t1,CA,CC及t2,CA,CC数据代入(C)式化简得:
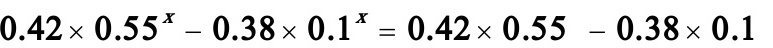
解之得:
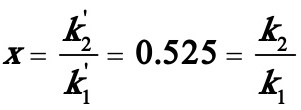
(2)先求出最大转化率:
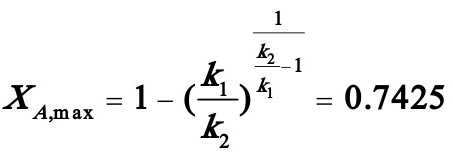
(3)产物C的最大收率:
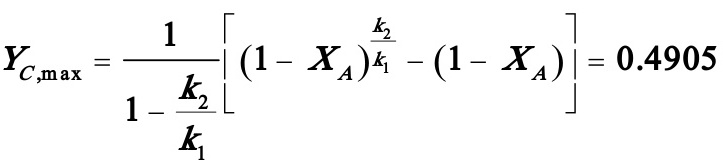
产物C的最大浓度:
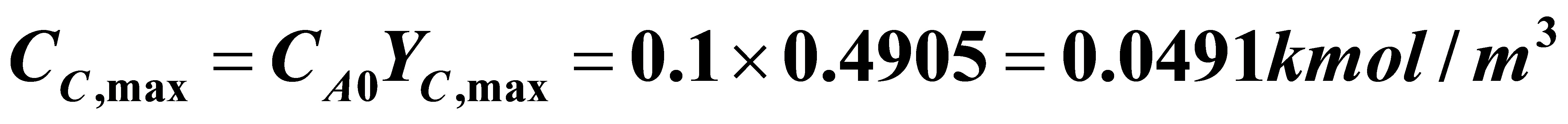
3.6 在等温间歇反应器中进行液相反应
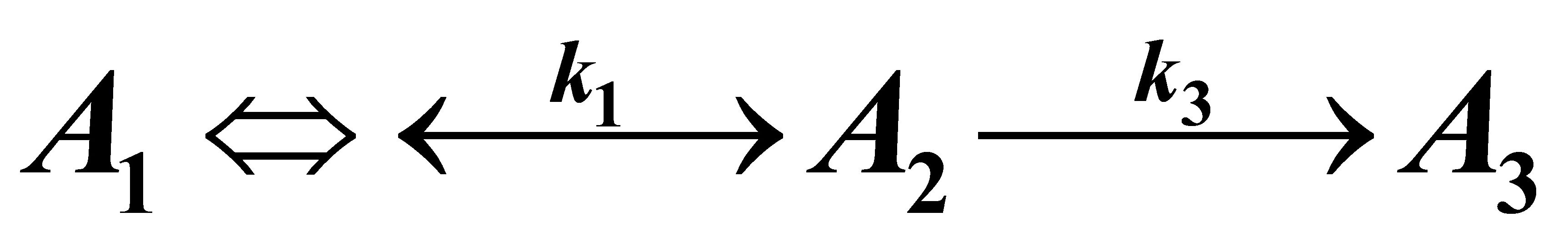
初始的反应物料中不含A2和A3,A1的浓度为2mol/l,在反应温度下k1=4.0min-1,k2=3.6min-1,k3=1.5min-1。试求:
(1)(1)反应时间为1.0min时,反应物系的组成。
(2)(2)反应时间无限延长时,反应物系的组成。
(3)(3)将上述反应改为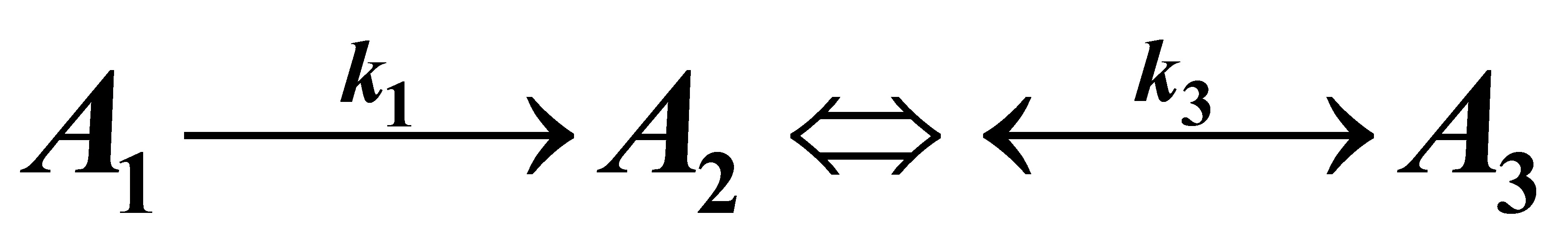 反应时间无限延长时,反应物系的组成。
反应时间无限延长时,反应物系的组成。
解:根据题中给的两种反应情况,可分别列出微分方程,然后进行求解。但仔细分析这两种情况,其实质是下述反应的特例:
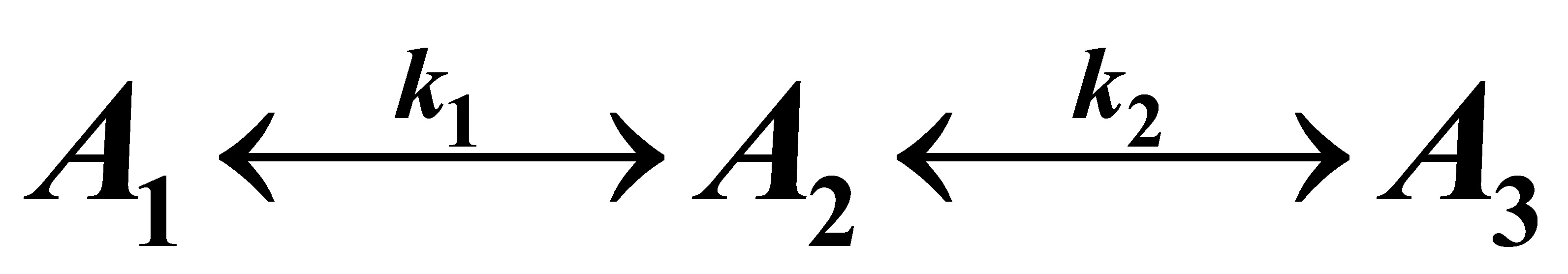 (A)
(A)
当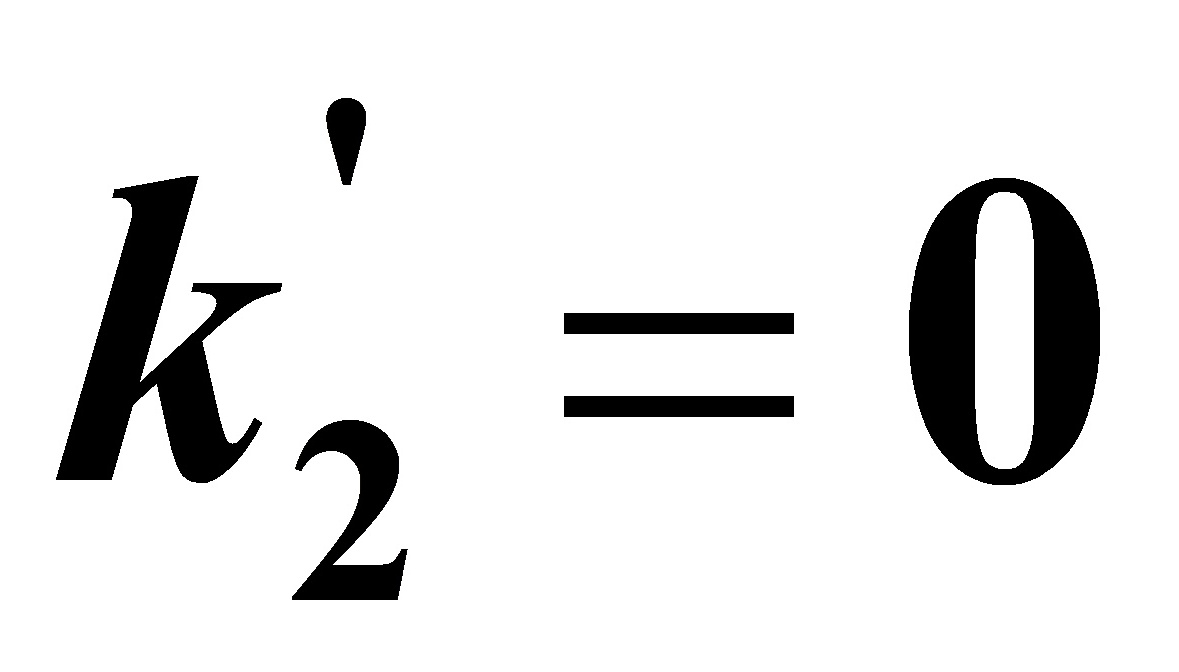 时,(A)式变为
时,(A)式变为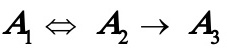 (B)
(B)
当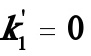 时,(A)式变为
时,(A)式变为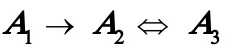 (C)
(C)
当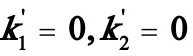 时,(A)式变为
时,(A)式变为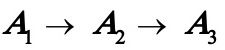 (D)
(D)
其中式(D)即为书讲的一级不可逆连串反应。可见只要得到(A)式的解,则可容易化简得到(B),(C)及(D)式的解。
对于(A)式,可列出如下微分方程组:
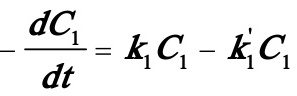 (1)
(1)
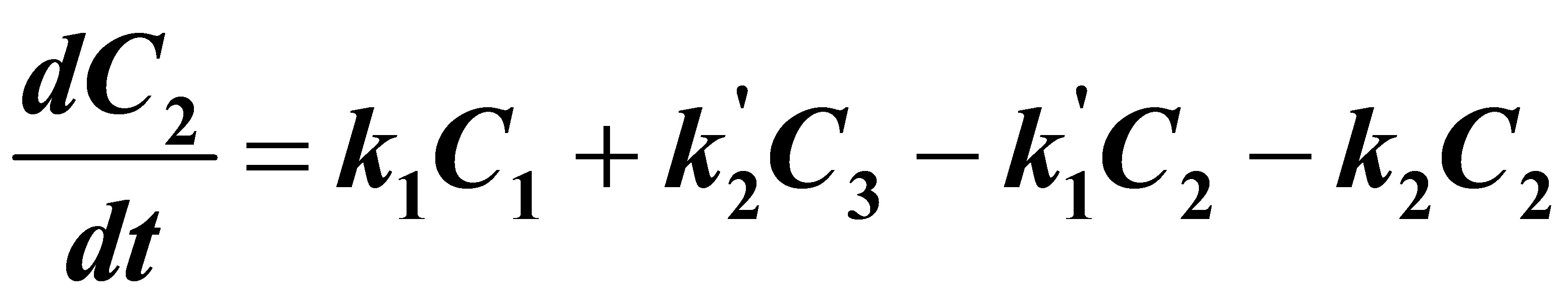 (2)
(2)
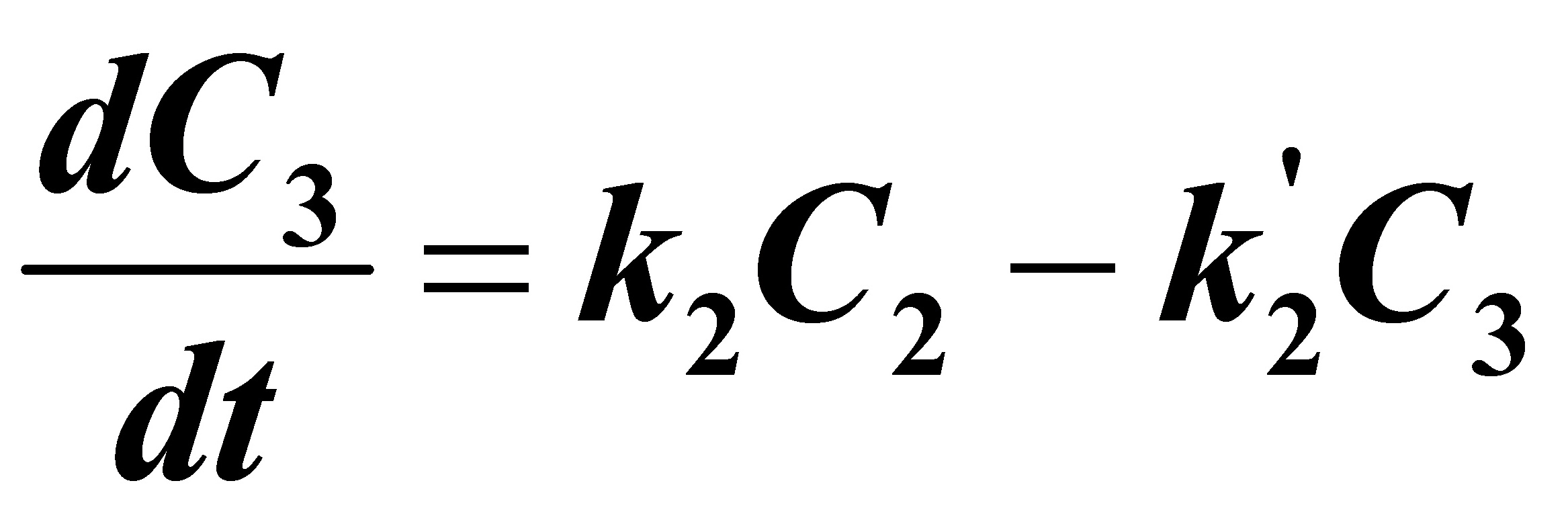 (3)
(3)
由题意知初始条件为:
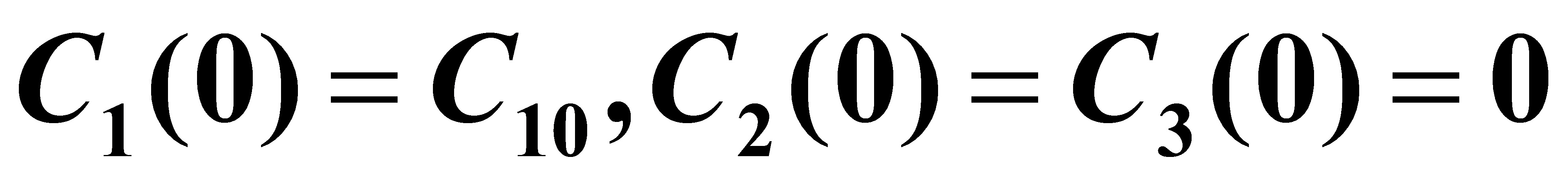 (4)
(4)
联立求解此微分方程组可得:
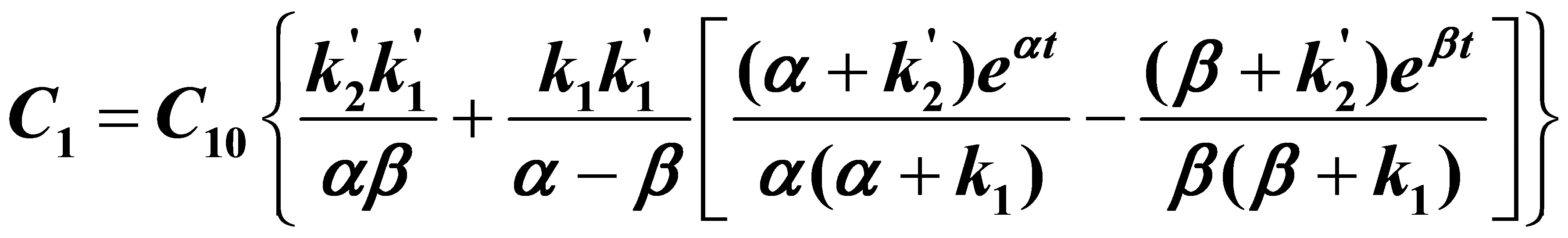 (5)
(5)
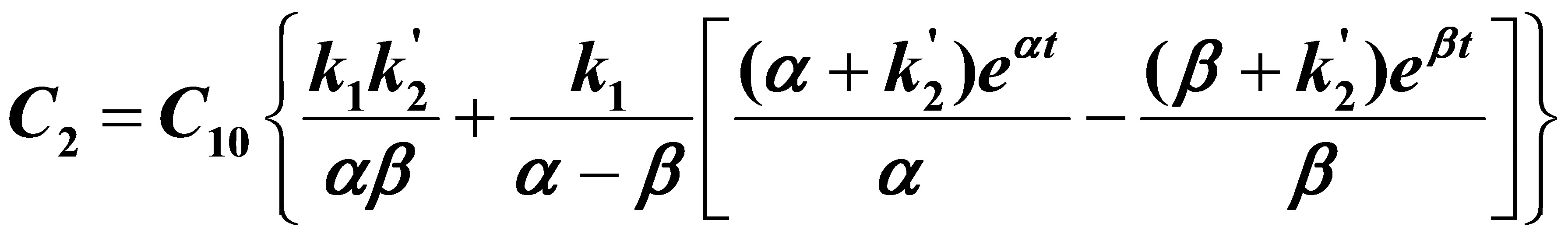 (6)
(6)
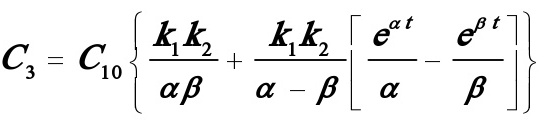 (7)
(7)
式中, 由如下式确定:
由如下式确定:
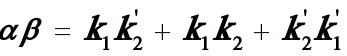 (8)
(8)
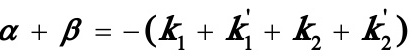 (9)
(9)
现在可用上述结果对本题进行计算:
(1)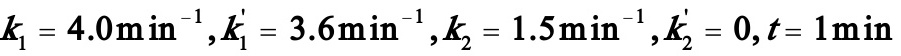
由(5)~(9)式得
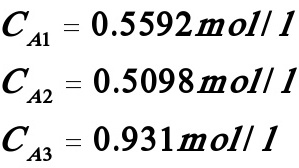
(2)当t→∝时,由(5)~(9)式得

(3)此时为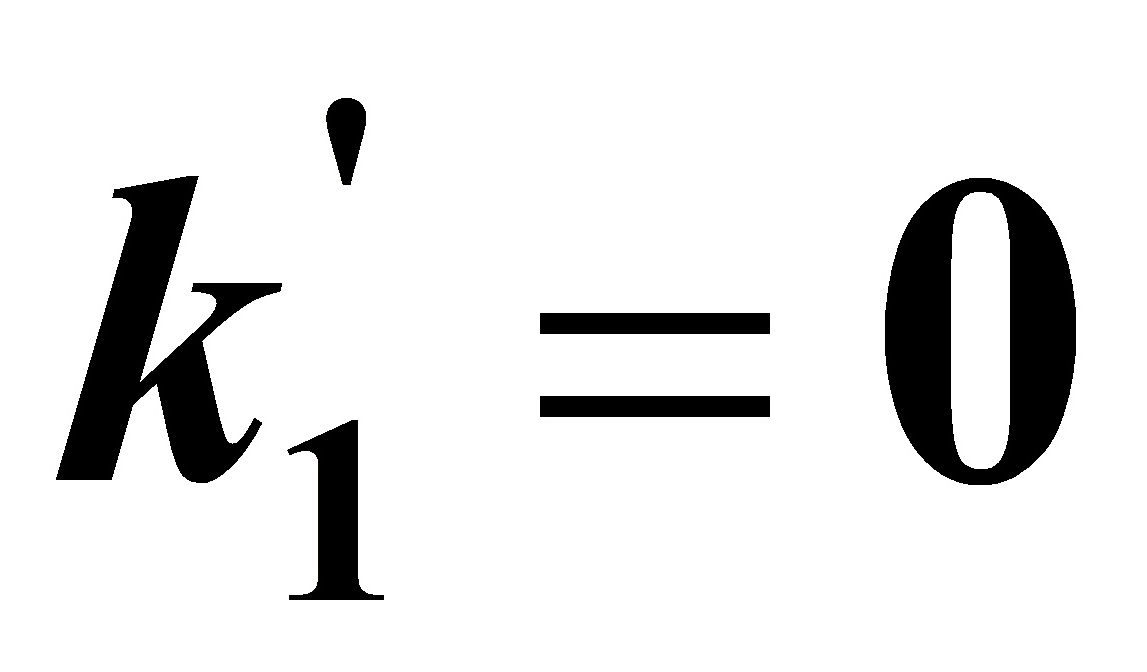 的情况,当t→∝时,由
的情况,当t→∝时,由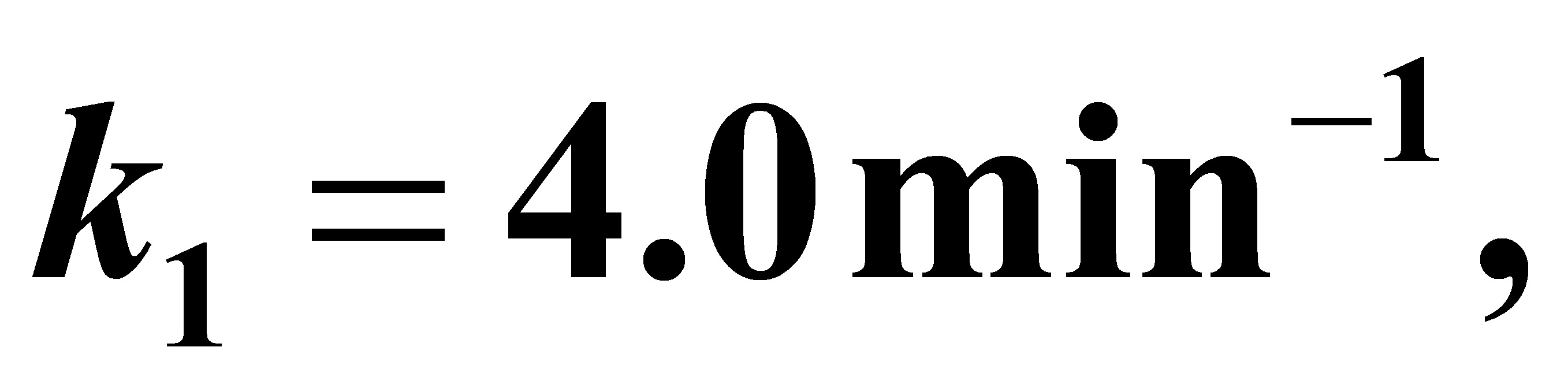
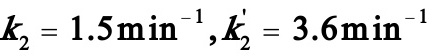 得:
得:
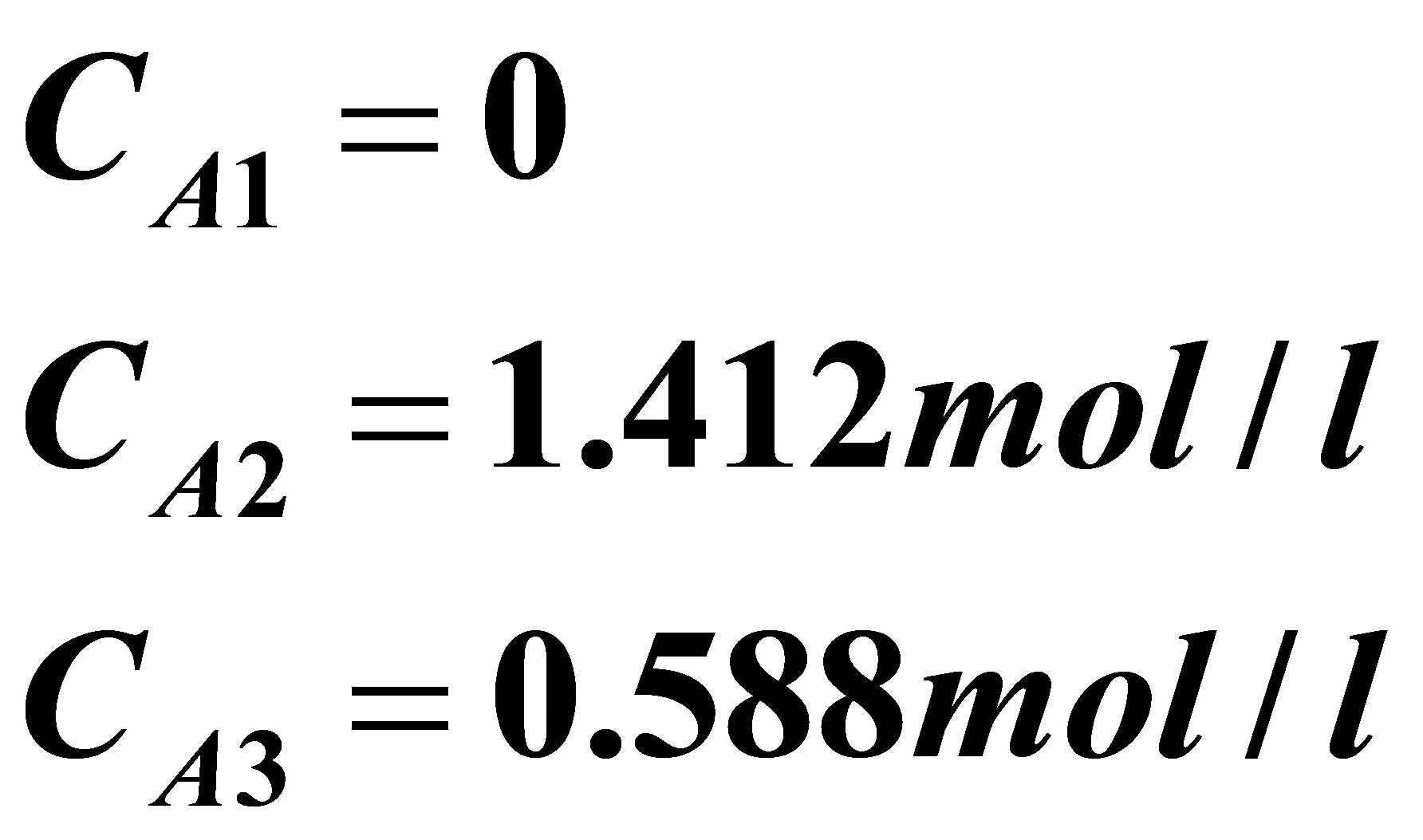
3.7拟设计一反应装置等温进行下列液相反应:
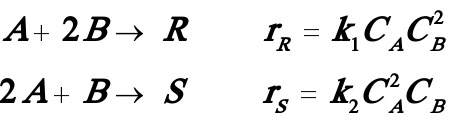
目的产物为R,B的价格远较A贵且不易回收,试问:
(1)(1)如何选择原料配比?
(2)
(3)(2)若采用多段全混流反应器串联,何种加料方式最好?
(4)
(5)(3)若用半间歇反应器,加料方式又如何?
(6)
解:(1)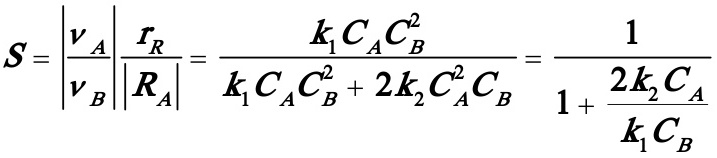
由上式知,欲使S增加,需使CA低,CB高,但由于B的价格高且不易回收,故应按主反应的计量比投料为好。
(2)保证CA低,CB高,故可用下图所示的多釜串联方式:
(3)用半间歇反应器,若欲使CA低,CB高,可以将B一次先加入反应器,然后滴加A.
3.8在一个体积为300l的反应器中86℃等温下将浓度为3.2kmol/m3的过氧化氢异丙苯溶液分解:
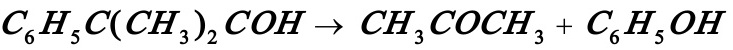
生产苯酚和丙酮。该反应为一级反应,反应温度下反应速率常数等于0.08s-1,最终转化率达98.9%,试计算苯酚的产量。
(1)(1)如果这个反应器是间歇操作反应器,并设辅助操作时间为15min;
(2)(2)如果是全混流反应器;
(3)(3)试比较上二问的计算结果;
(4)(4)若过氧化氢异丙苯浓度增加一倍,其他条件不变,结果怎样?
(5)
解:(1)
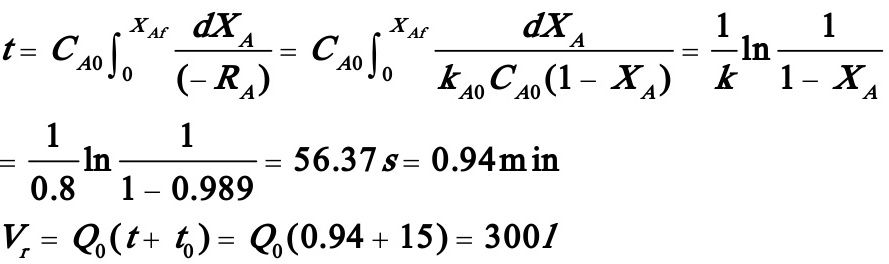
苯酚浓度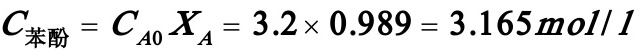
苯酚产量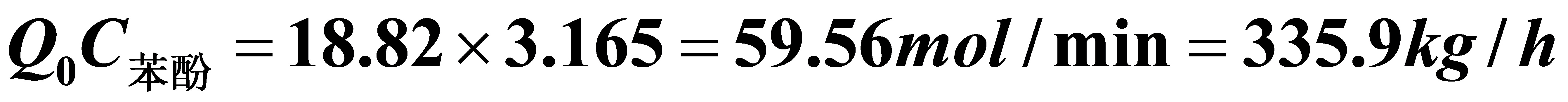
(2)全混流反应器
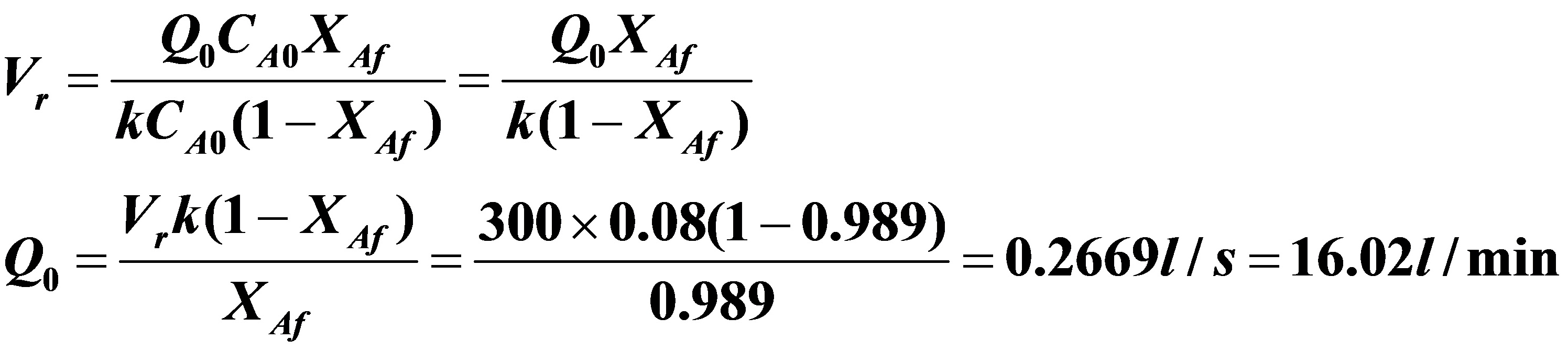
苯酚产量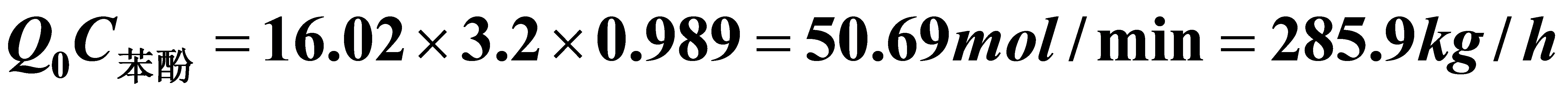
(3)说明全混釜的产量小于间歇釜的产量,这是由于全混釜中反应物浓度低,反应速度慢的原因。
(4)由于该反应为一级反应,由上述计算可知,无论是间歇反应器或全混流反应器,其原料处理量不变,但由于CAB增加一倍,故C苯酚也增加一倍,故上述两个反应器中苯酚的产量均增加一倍。
3.9在间歇反应器中等温进行下列液相反应:
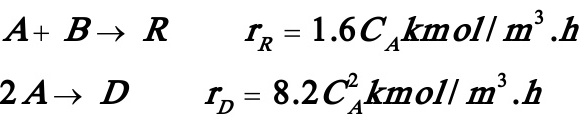
rD及rR分别为产物D及R的生成速率。反应用的原料为A及B的混合液,其中A的浓度等于2kmol/m3。
(1)(1)计算A的转化率达95%时所需的反应时间;
(2)(2)A的转化率为95%时,R的收率是多少?
(3)
(4)(3)若反应温度不变,要求D的收率达70%,能否办到?
(5)
(6)(4)改用全混反应器操作,反应温度与原料组成均不改变,保持空时与(1)的反应时间相同,A的转化率是否可达到95%
(7)
(8)(5)在全混反应器中操作时,A的转化率如仍要求达到95%,其它条件不变,R的收率是多少?
(9)
(10)(6)若采用半间歇操作,B先放入反应器内,开始反应时A按(1)计算的时间均速加入反应器内。假如B的量为1m3,A为0.4m3,试计算A加完时,组分A所能达到的转化率及R的收率。
解:(1)第二章2.9题已求出t=0.396h=24.23min
(2)
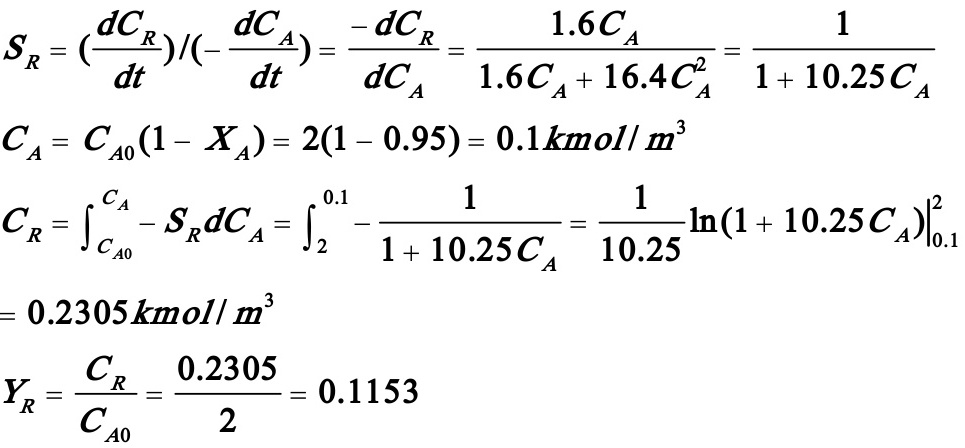
(3)若转化率仍为0.95,且温度为常数,则D的瞬时选择性为:
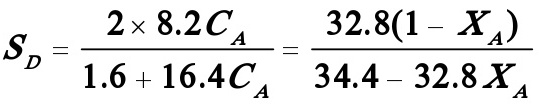
D的收率:
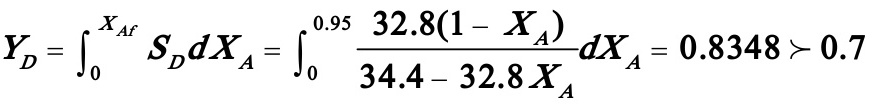
这说明能使D的收率达到70%
(4)对全混流反应器,若使τ=t=0.3958h,则有
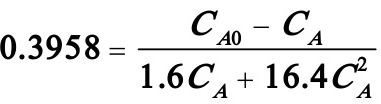
解之得:CA=0.4433
所以: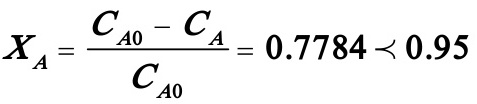
这说明在这种情况下转化率达不到95%。
(6)(5)对全混流反应器,若X=0.95,则R的收率为:
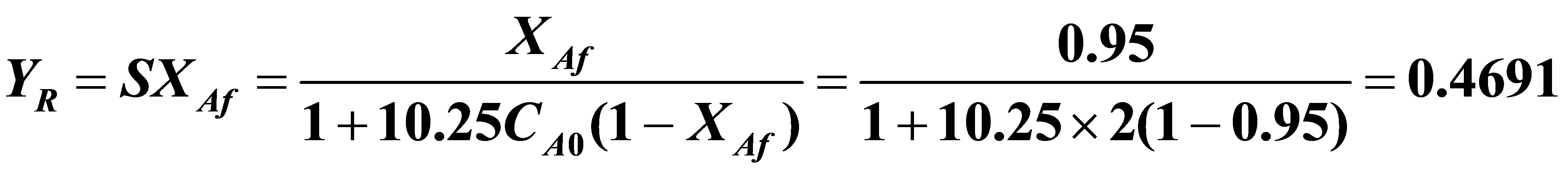
(6)依题意知半间歇式反应器属于连续加料而间歇出料的情况。为了求分组A的转化率及R的收率,需要求出A及R 的浓度随时间的变化关系,现列出如下的微分方程组:
对A: 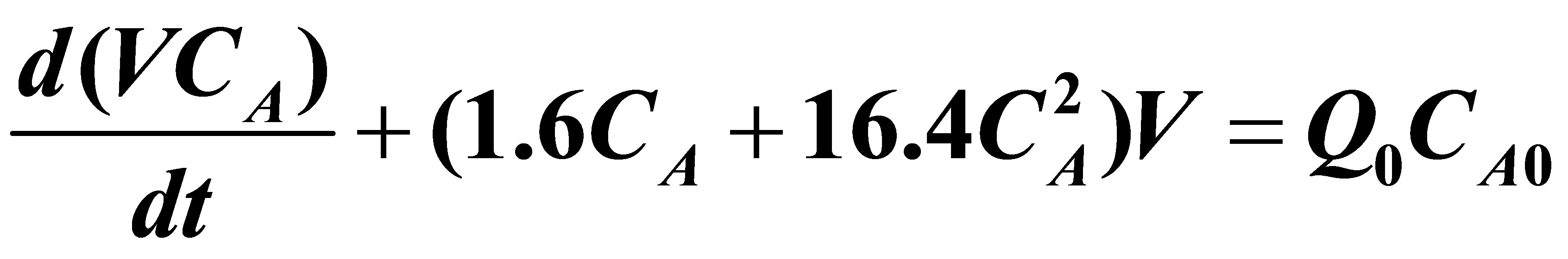 (1)
(1)
对R:
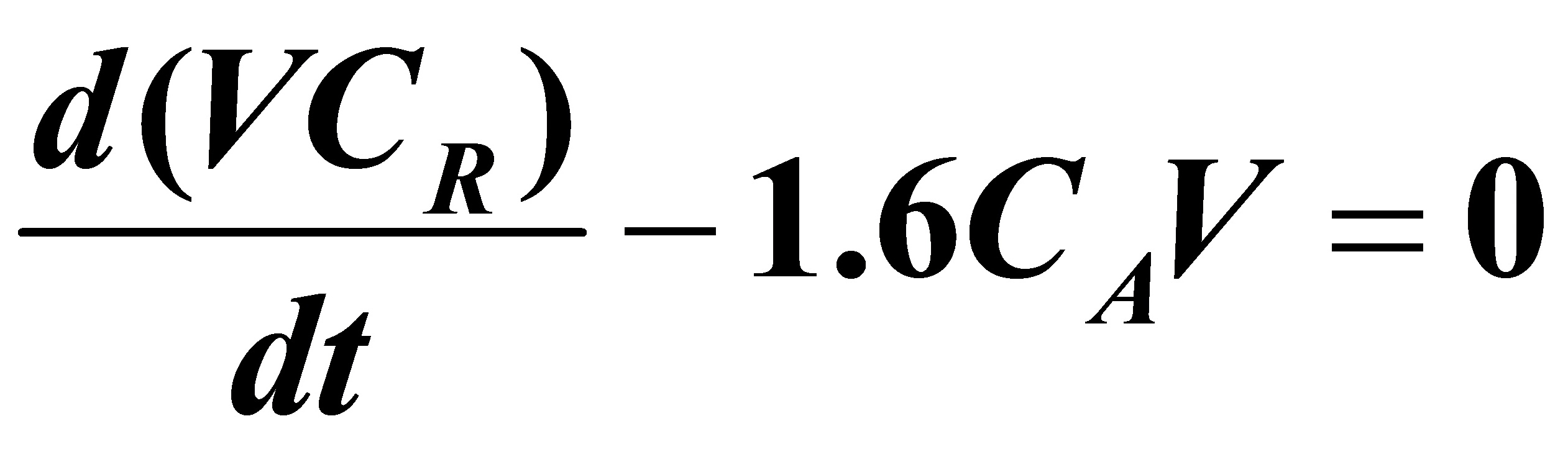 (2)
(2)
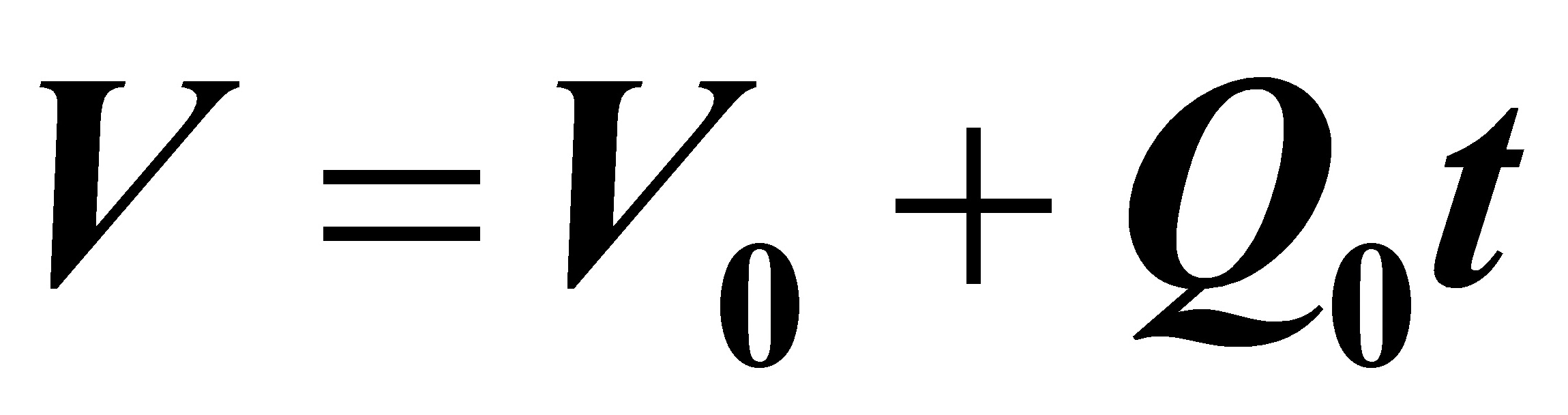 (3)
(3)
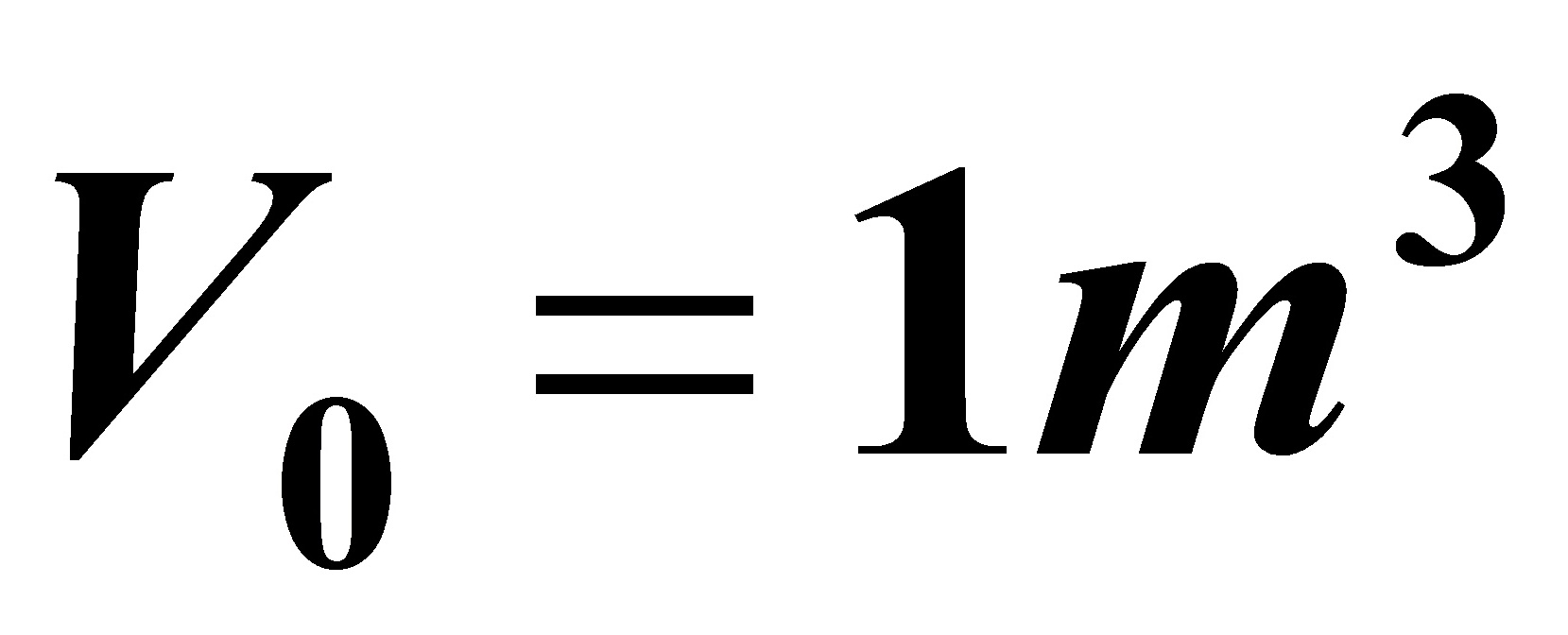
在反应时间(t=0.4038h,为方便起见取t ≈0.4h)内将0.4 m3的A均速加入反应器内,故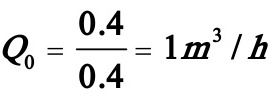
采用间歇釜操作时,原料为A与B的混合物,A的浓度为2kmol/ m3.现采用半间歇釜操作,且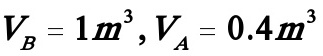 ,故可算出原料A的浓度为:
,故可算出原料A的浓度为: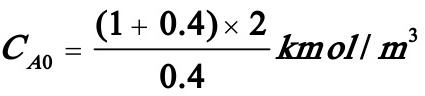
由于:
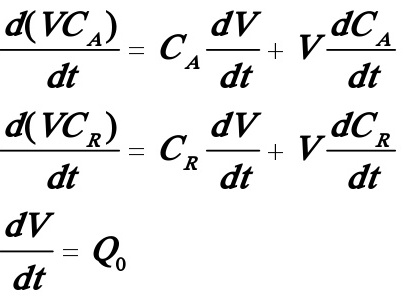
代入(1),(2)式则得如下一阶非线性微分方程组:
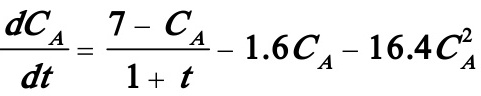 (4)
(4)
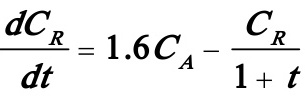 (5)
(5)
初始条件:t=0,CA=0,CR=0
可用龙格---库塔法进行数值求解。取步长△t=0.02h,直至求至t=0.4h即可。用t=0.4h时的CA和CR可以进行A的转化率和R的收率计算: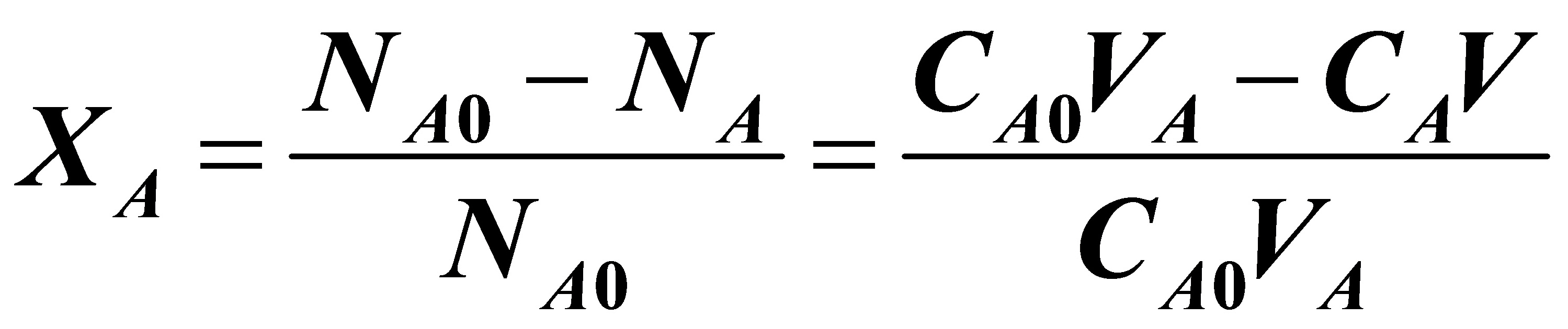
式中VA为所加入的A的体积,且VA=0.4m3;CA0为所加入的A的浓度,且CA0=7kmol/m3;V为反应结束时物系的体积,V=1.4m3。
同理可以计算出R的收率: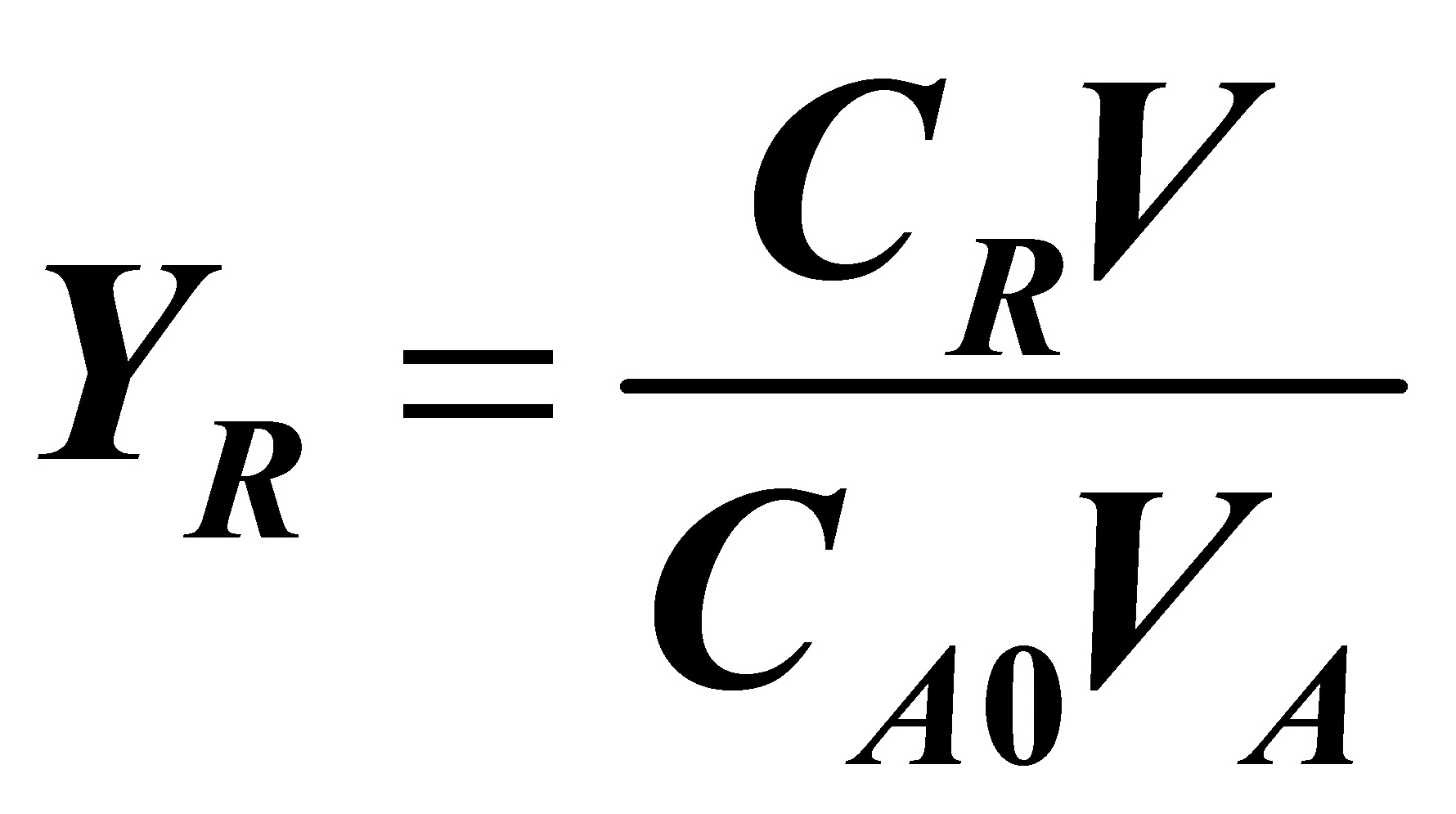
3.10在两个全混流反应器串联的系统中等温进行液相反应:
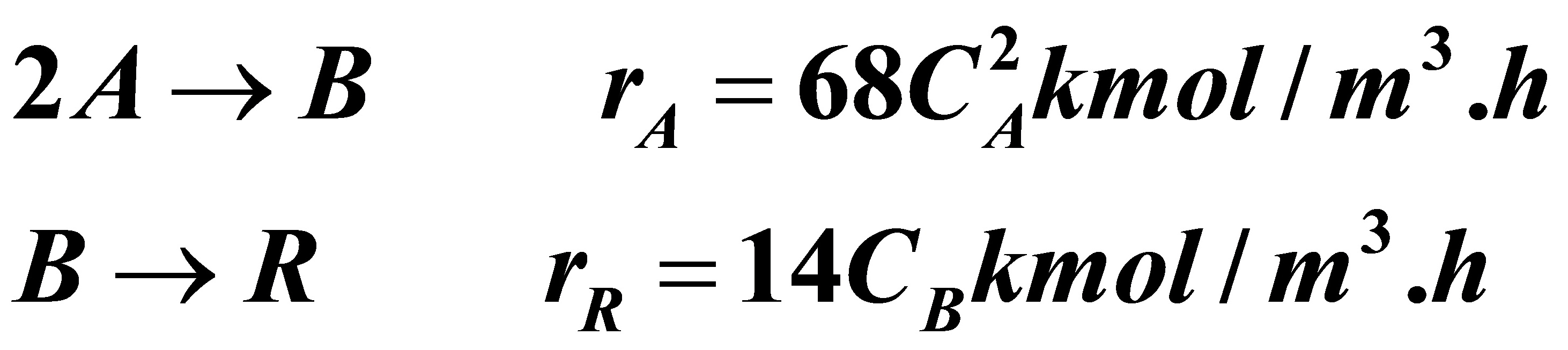
加料中组分A的浓度为0.2kmol/m3,流量为4m3/h,要求A的最终转化率为90%,试问:
(1)(1)总反应体积的最小值是多少?
(2)
(3)(2)此时目的产物B的收率是多少?
(4)
(5)(3)如优化目标函数改为B的收率最大,最终转化率为多少此时总反应体积最小值是多少
解:(1)
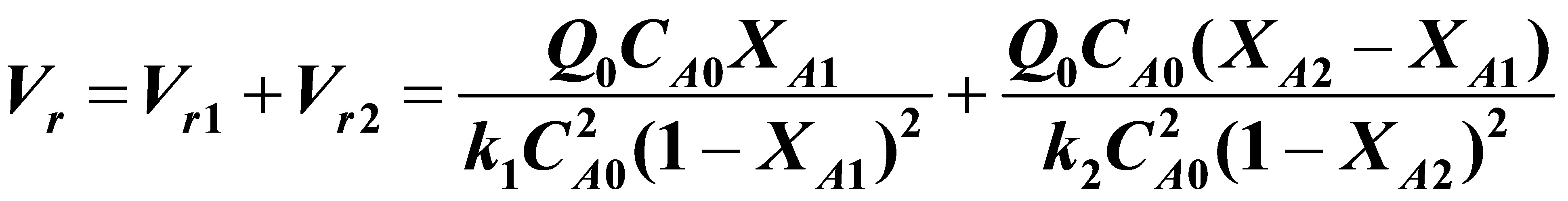
对上式求dVr/dXA1=0可得: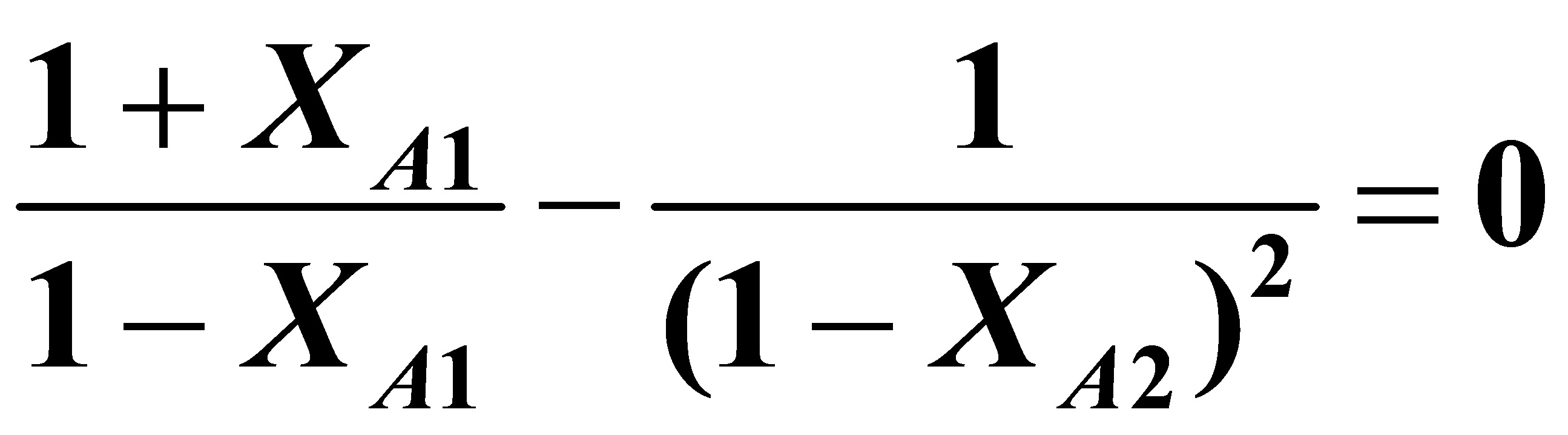
将XA2=0.9代入上式,则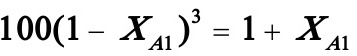
解之得XA1=0.741
所以总反应体积的最小值为
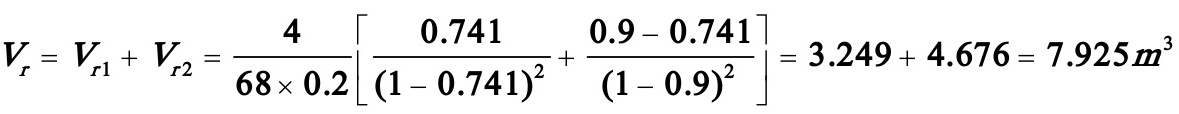
(2)
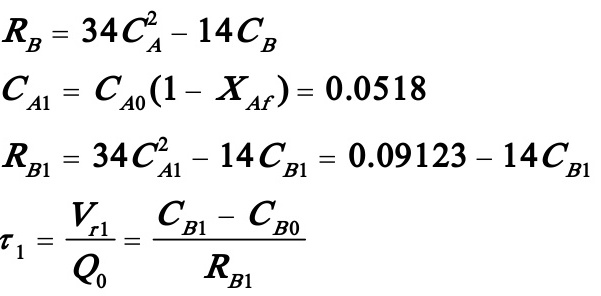
即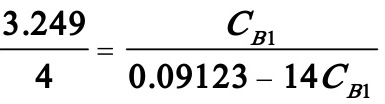
解得CB1=0.005992 kmol/m3
同理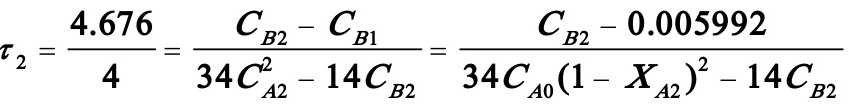
解得CB2=0.00126 kmol/m3
B的收率: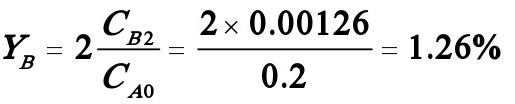
(3)目标函数改为B的收率,这时的计算步骤如下:对于第i个釜,组分A,B的衡算方程分别为:
对A: 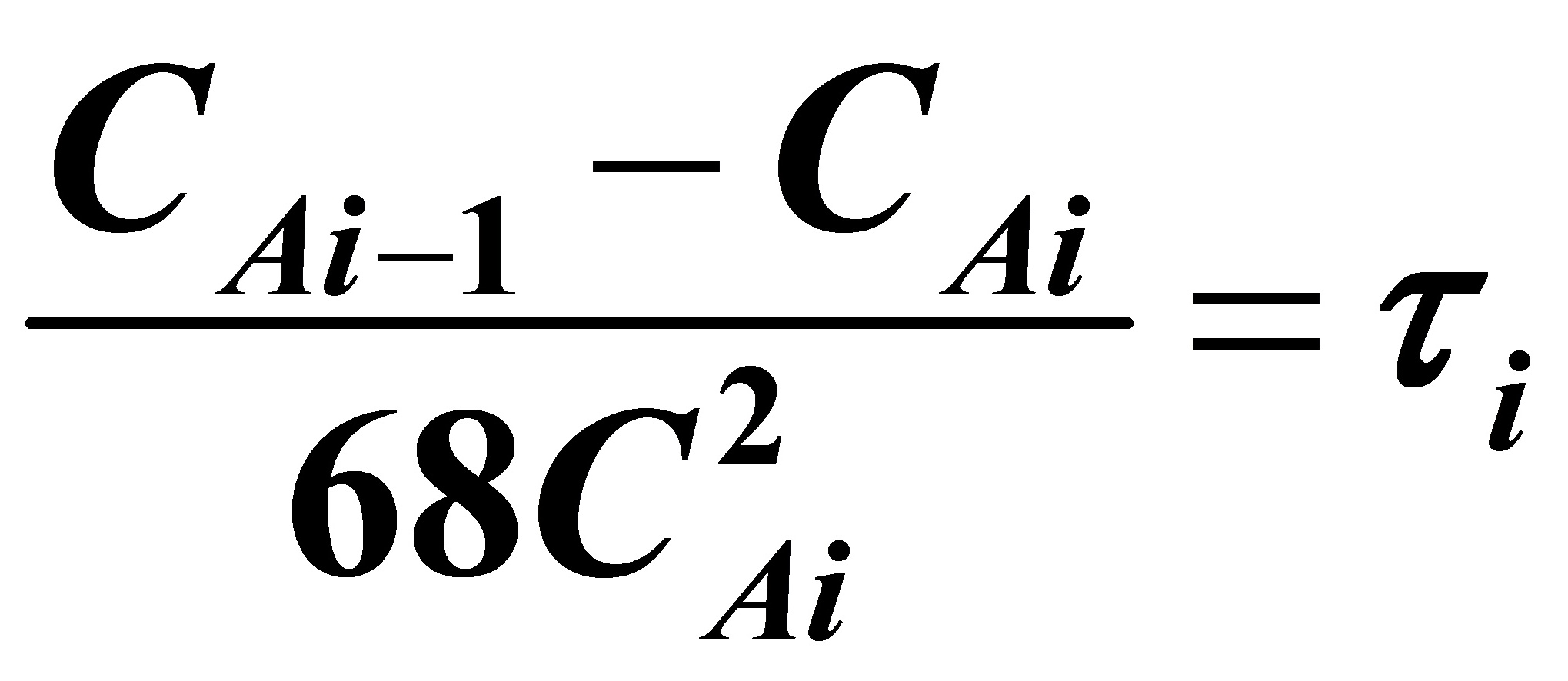
对B: 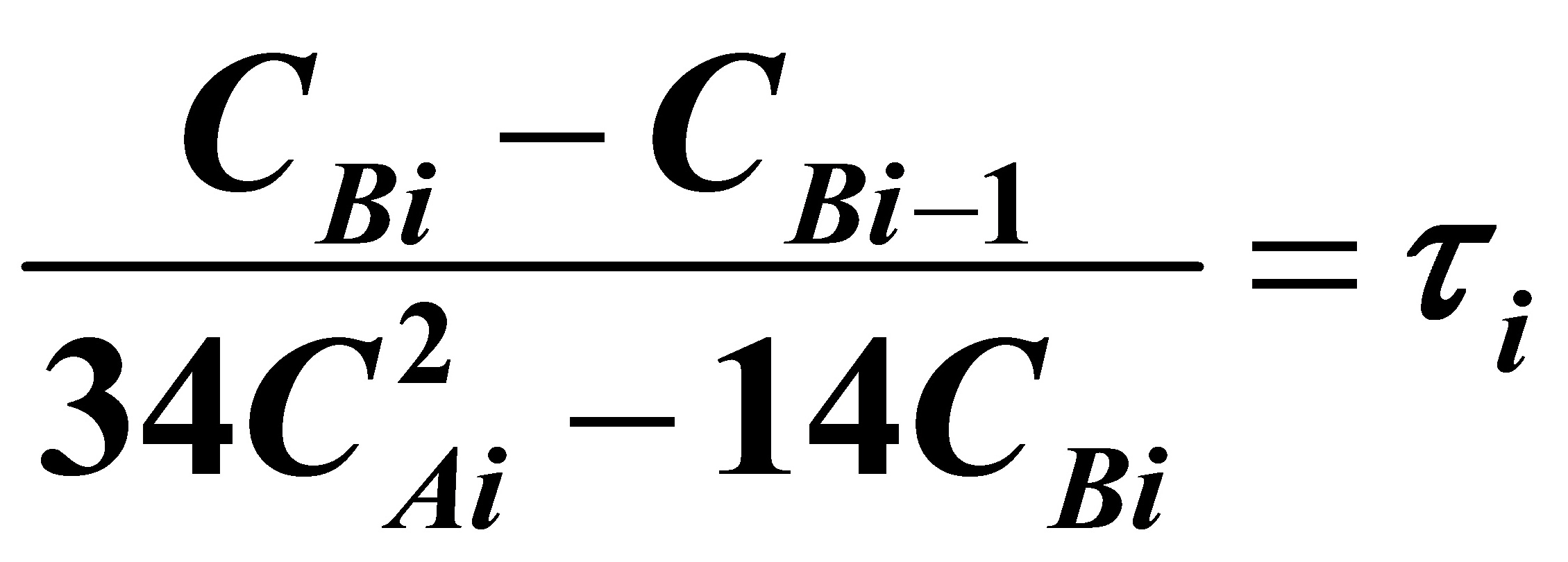
当i=1时,
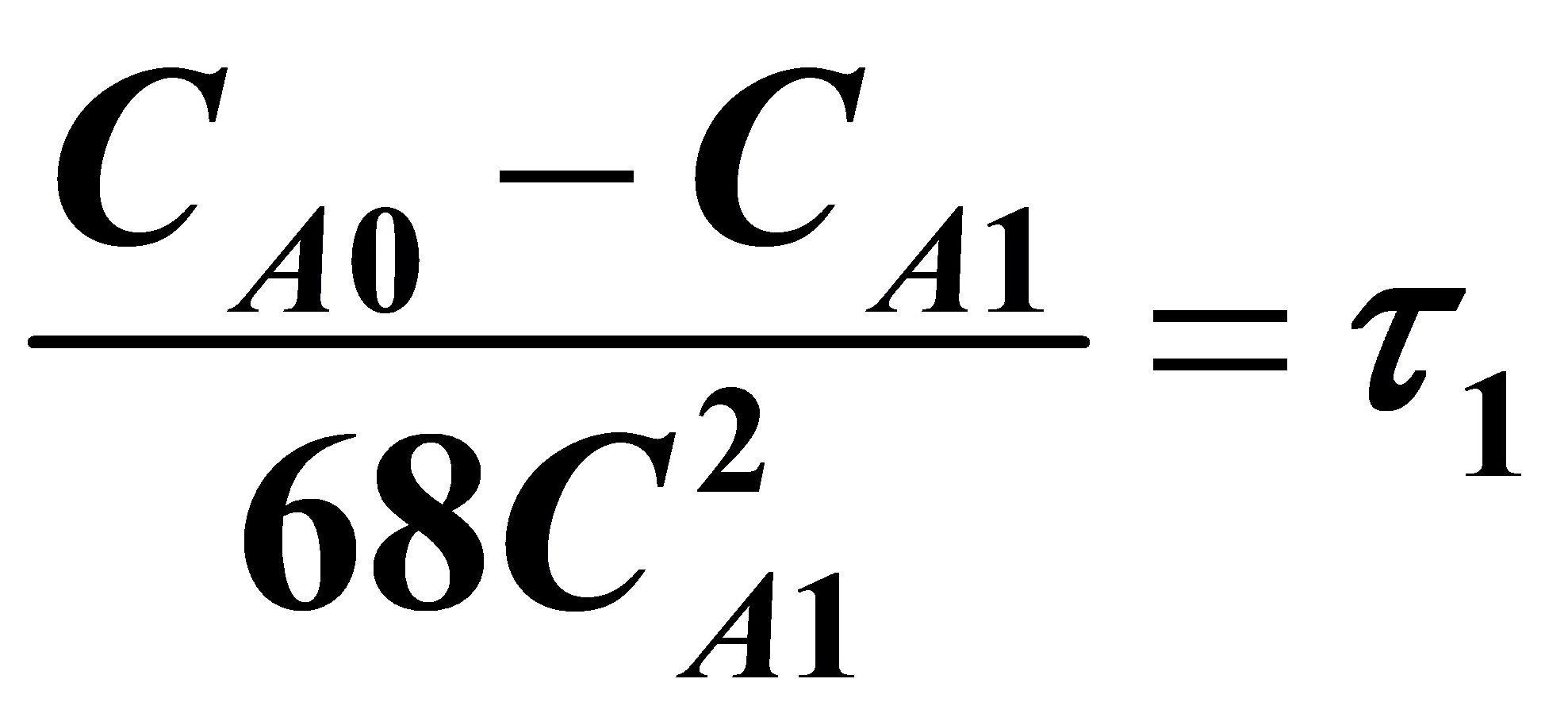 (1)
(1)
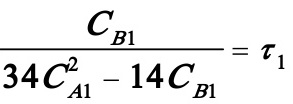 (2)
(2)
当i=2时,
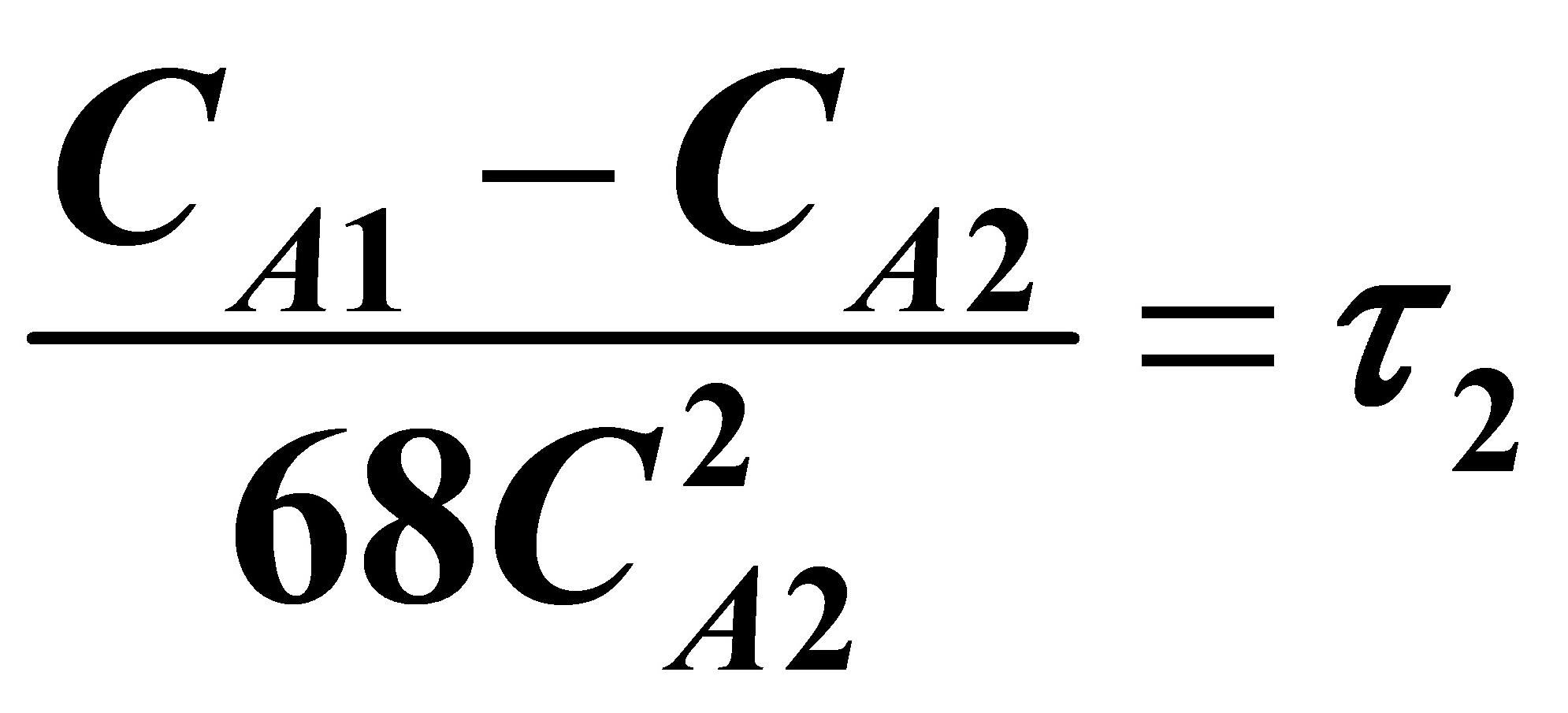 (3)
(3)
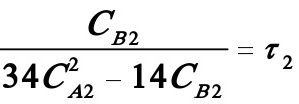 (4)
(4)
由(1)式解出CA1代入(2)式可解出CB1; 由(1)式解出CA1代入(3)式可解出CA2;将CB1及CA2代入(4)式可解出CB2,其为τ1,τ2的函数,即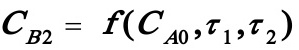 (5)
(5)
式中CA0为常数。由题意,欲使CB2最大,则需对上述二元函数求极值:
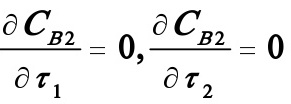
联立上述两个方程可以求出τ1及τ2。题中已给出Q,故由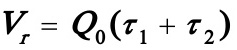 可求出CB2最大时反应器系统的总体积。将τ1,τ2代入(5)式即可求出B的最高浓度,从而可进一步求出YBmaX.将τ1,τ2代入CA2,则由XA2=(CA0-CA2)/CA0可求出最终转化率。
可求出CB2最大时反应器系统的总体积。将τ1,τ2代入(5)式即可求出B的最高浓度,从而可进一步求出YBmaX.将τ1,τ2代入CA2,则由XA2=(CA0-CA2)/CA0可求出最终转化率。
3.11在反应体积为490cm3的CSTR中进行氨与甲醛生成乌洛托品的反应: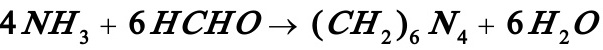
式中(A)--NH3,(B)—HCHO,反应速率方程为:

式中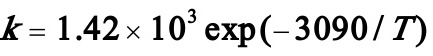 。氨水和甲醛水溶液的浓度分别为1.06mol/l和6.23mol/l,各自以1.50cm3/s的流量进入反应器,反应温度可取为36℃,假设该系统密度恒定,试求氨的转化率XA及反应器出口物料中氨和甲醛的浓度CA及CB。
。氨水和甲醛水溶液的浓度分别为1.06mol/l和6.23mol/l,各自以1.50cm3/s的流量进入反应器,反应温度可取为36℃,假设该系统密度恒定,试求氨的转化率XA及反应器出口物料中氨和甲醛的浓度CA及CB。
解:
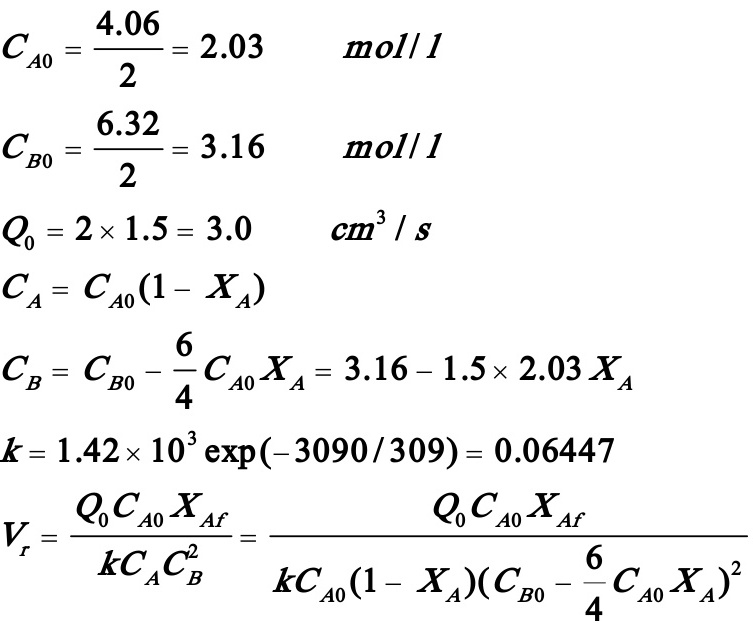
即得: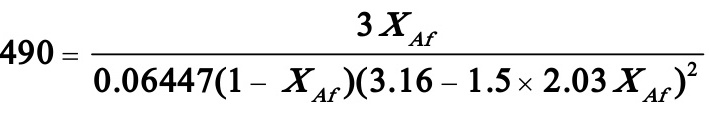
整理得: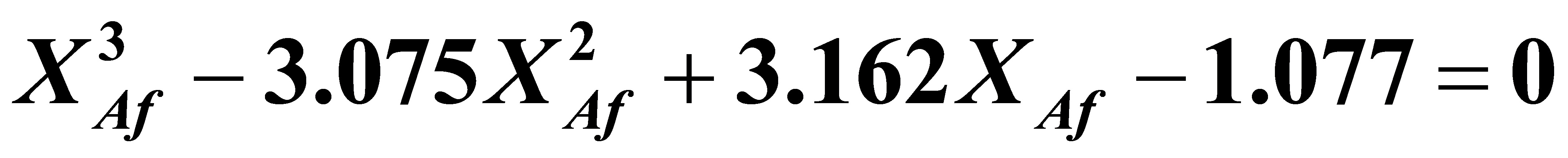
解得:XAf=0.821
反应器出口A,B得浓度分别为:
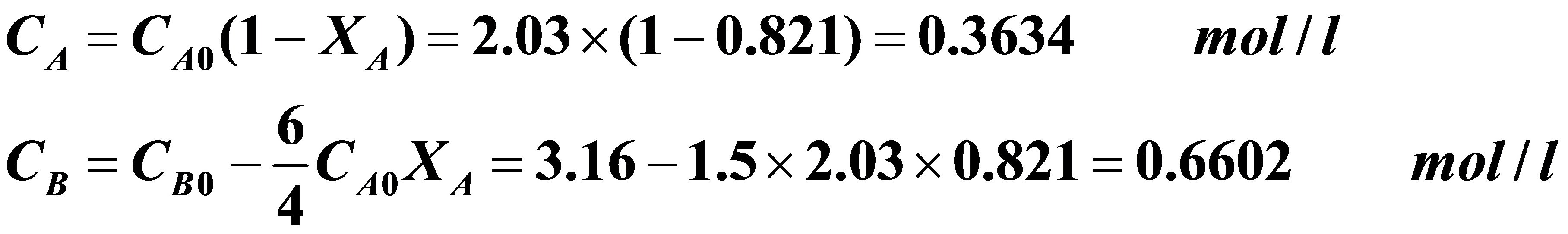
3.12在一多釜串联系统,2.2kg/h的乙醇 和1.8kg.h的醋酸进行可逆反应。各个反应器的体积均为0.01m3,反应温度为100℃,酯化反应的速率常数为4.76×10-4l/mol.min,逆反应(酯的水解)的速率常数为1.63×10-4 l/mol.min。反应混合物的密度为864kg/m3,欲使醋酸的转化率达60%,求此串联系统釜的数目。
解:等体积的多釜串联系统
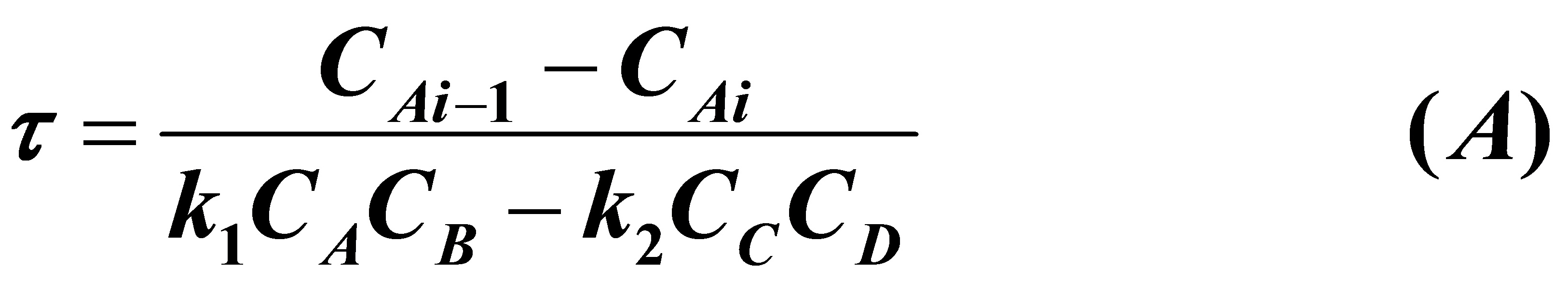
A,B,C,D分别代表乙酸,乙酸乙酯和水。由计量关系得:
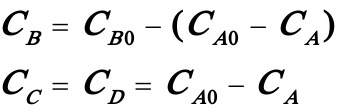
从已知条件计算出:
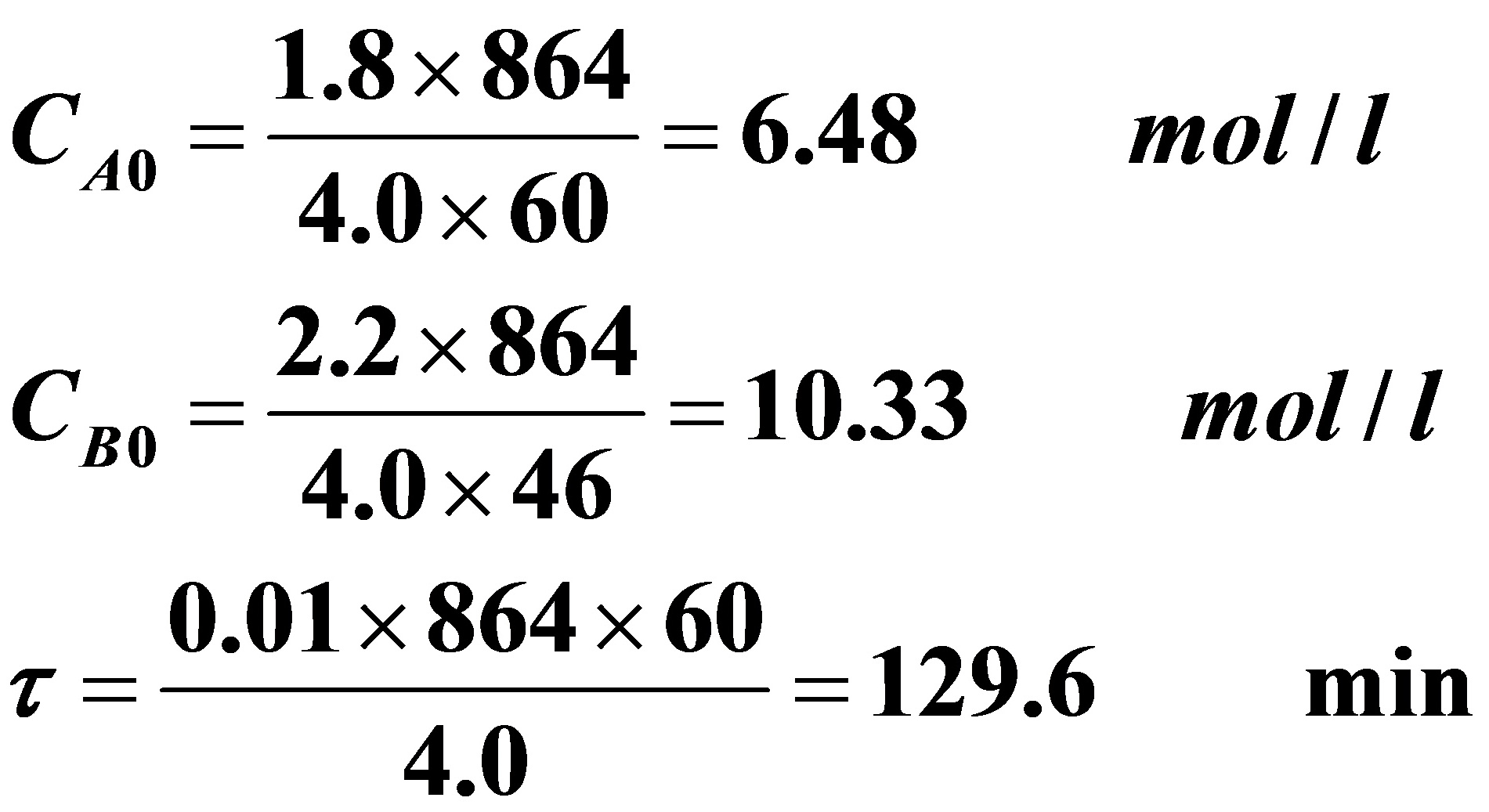
将上述数据代入(A)式,化简后得到:
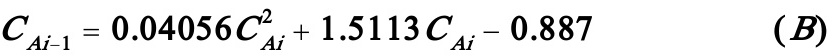
若i=1,则(B)式变为: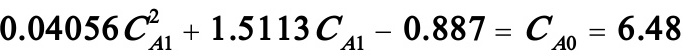
解之得: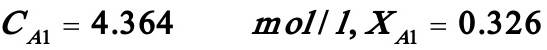
若i=2,则(B)式变为: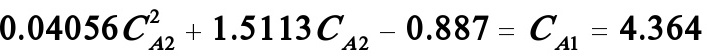
解之得: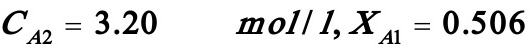
若i=3,则(B)式变为: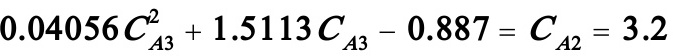
解之得: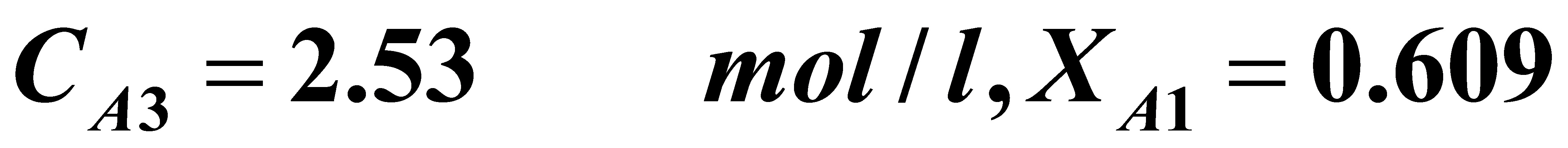
即:三釜串联能满足要求。
3.13以硫酸为催化剂,由醋酸和丁醇反应可制得醋酸丁酯。仓库里闲置着两台反应釜,一台的反应体积为3m3,另一台则为1m3。现拟将它们用来生产醋酸丁酯,初步决定采用等温连续操作,原料中醋酸的0.浓度为0.15kmol/m3,丁酯则大量过剩,该反应对醋酸为2级,在反应温度下反应速率常数等于1.2m3/h.kmol,要求醋酸的最终转化率不小于50%,这两台反应釜可视为全混反应器,你认为采用怎样的串联方式醋酸丁酯的产量最大为什么试计算你所选用的方案得到的醋酸丁酯产量。如果进行的反应是一级反应,这两台反应器的串联方式又应如何
解:因为反应级数大于1,所以联立方式应当是小釜在前,大釜在后才能使醋酸丁酯产量最大。现进行计算:
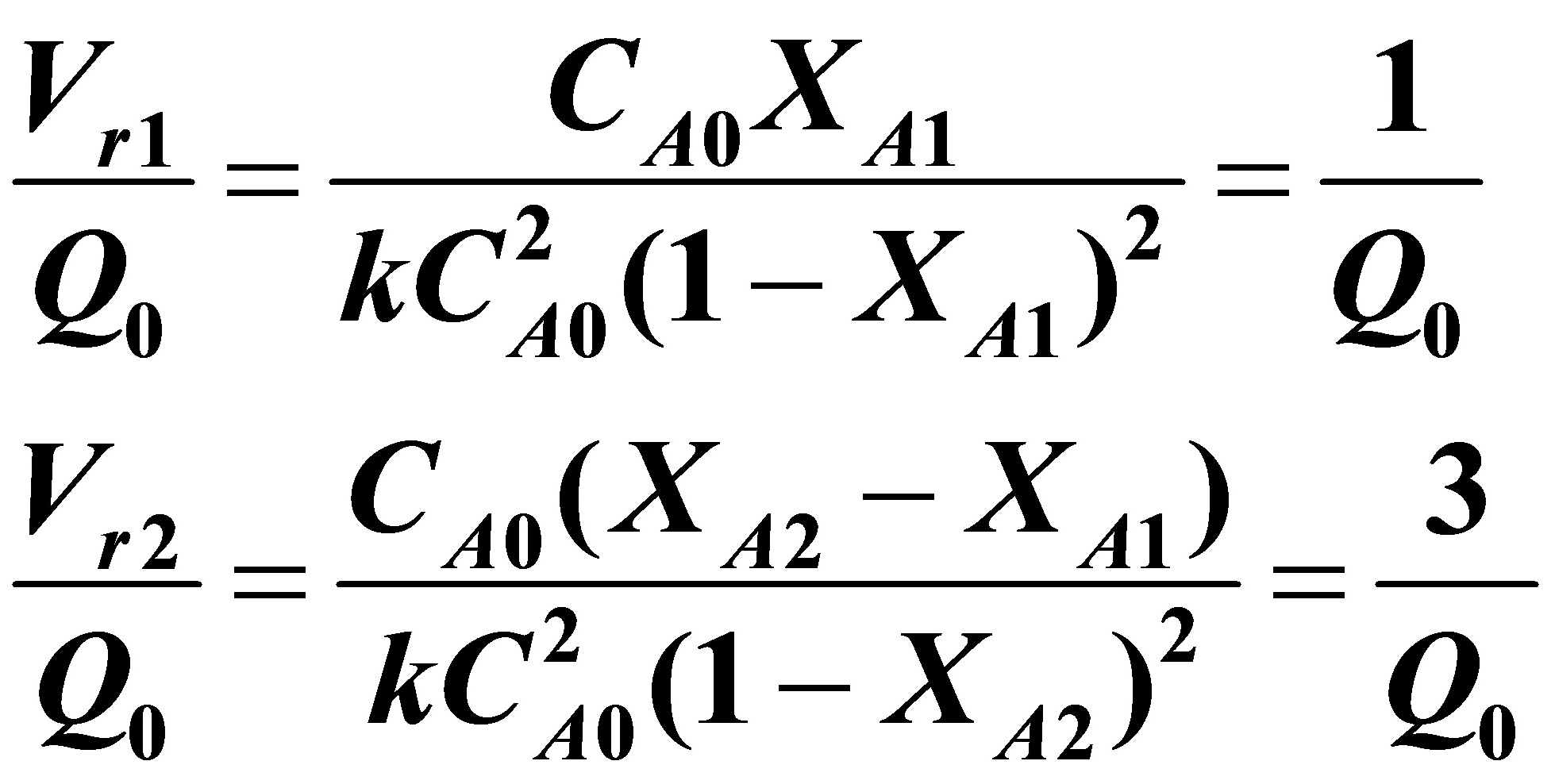
二式联立化简后得到:(将XA2=0.5代入)
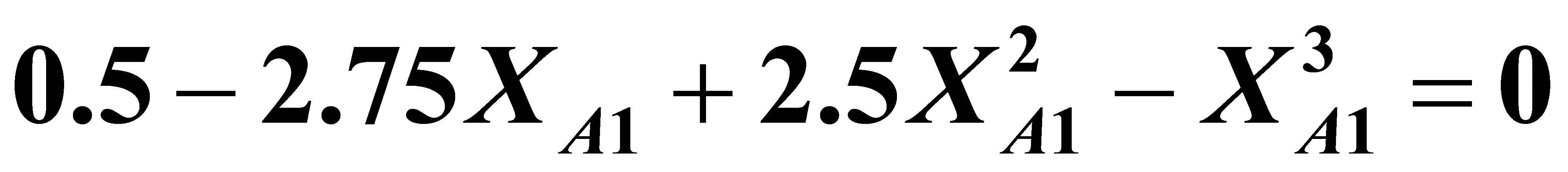
解之得:XA1=0.223
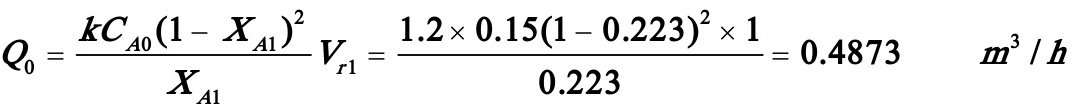
醋酸丁酯产量=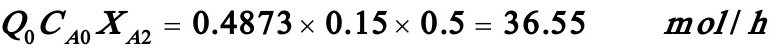
如果进行的是一级反应,可进行如下计算:
(1)(1)小反应器在前,大反应器在后:
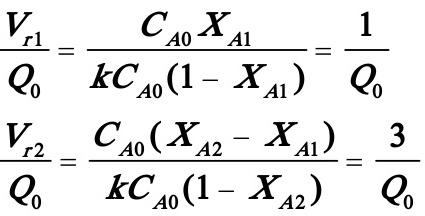
联立二式,且将XA2=0.5代入,化简后得到:
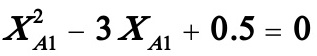
解得:XA1=0.1771
所以有: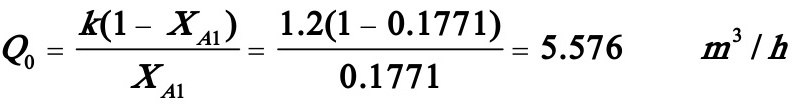
醋酸丁酯产量=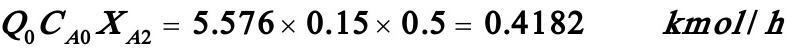
(2)大反应器在前,小反应器在后:
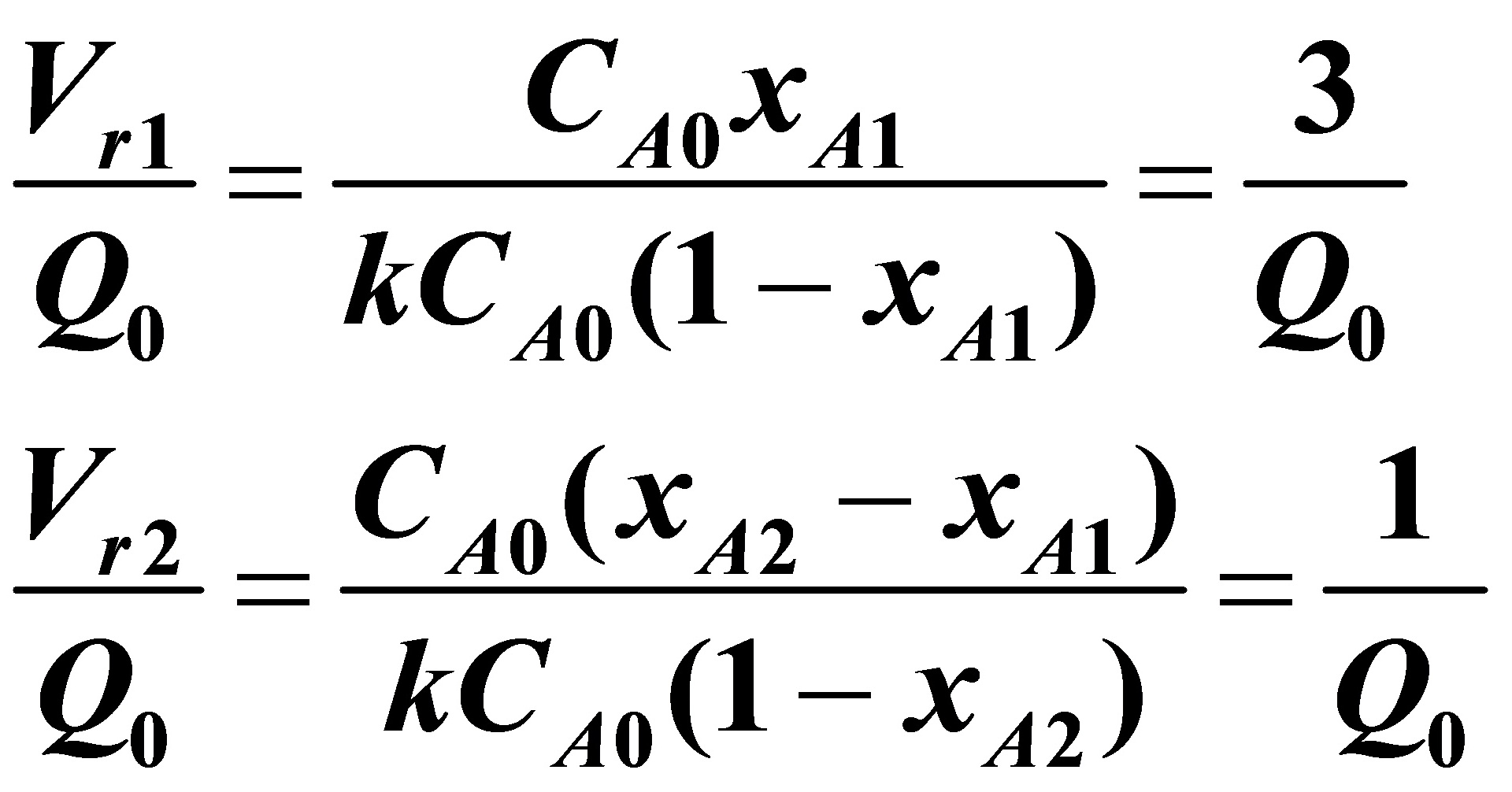
解得XA1=0.3924