题目
已知298K时,△fG8((CO,g)=-137.3kJ·mol-1,△fG8((CO2,g)=-394.4kJ·mol-1,反应Al2O3(s)+3CO(g)→3CO2(g)+2Al(s)的△rG8(=793.0kJ·mol-1,则在标准态下,反应向__________方向进行;△fG8((Al2O3,s)=__________kJ·mol-1。
已知298K时,△fG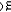 (CO,g)=-137.3kJ·mol-1,△fG
(CO,g)=-137.3kJ·mol-1,△fG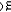 (CO2,g)=-394.4kJ·mol-1,反应
(CO2,g)=-394.4kJ·mol-1,反应
Al2O3(s)+3CO(g)→3CO2(g)+2Al(s)的△rG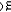 =793.0kJ·mol-1,则在标准态下,反应向__________方向进行;△fG
=793.0kJ·mol-1,则在标准态下,反应向__________方向进行;△fG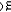 (Al2O3,s)=__________kJ·mol-1。
(Al2O3,s)=__________kJ·mol-1。
题目解答
答案
左;-1564.3。
解析
考查要点:本题主要考查吉布斯自由能变化(ΔG)的计算及其对反应方向的判断,以及利用化学反应式计算物质的生成吉布斯自由能(ΔfG)。
解题核心思路:
- 判断反应方向:根据反应的ΔrG值,若ΔrG > 0,反应逆向(向左)进行;若ΔrG < 0,反应正向(向右)进行。
- 计算ΔfG(Al₂O₃):利用反应式中各物质的ΔfG关系,结合ΔrG的公式建立方程求解。
破题关键点:
- ΔrG的公式:ΔrG = ΣΔfG(产物) - ΣΔfG(反应物)。
- 单质的ΔfG为0:如Al(s)为单质,其ΔfG = 0。
判断反应方向
题目中给出ΔrG = 793.0 kJ·mol⁻¹,ΔrG > 0,说明反应逆向(向左)进行。
计算ΔfG(Al₂O₃)
根据ΔrG的公式:
$\Delta_r G = \sum \Delta_f G(\text{产物}) - \sum \Delta_f G(\text{反应物})$
代入已知数据:
- 产物:3 mol CO₂(g),ΔfG(CO₂) = -394.4 kJ·mol⁻¹;2 mol Al(s),ΔfG(Al) = 0。
- 反应物:1 mol Al₂O₃(s),ΔfG(Al₂O₃) = ?;3 mol CO(g),ΔfG(CO) = -137.3 kJ·mol⁻¹。
建立方程:
$793.0 = [3 \times (-394.4) + 2 \times 0] - \left[ \Delta_f G(\text{Al}_2\text{O}_3) + 3 \times (-137.3) \right]$
分步计算:
- 计算产物总ΔfG:
$3 \times (-394.4) = -1183.2 \, \text{kJ}$ - 计算反应物总ΔfG:
$\Delta_f G(\text{Al}_2\text{O}_3) + 3 \times (-137.3) = \Delta_f G(\text{Al}_2\text{O}_3) - 411.9$ - 代入方程:
$793.0 = -1183.2 - \left( \Delta_f G(\text{Al}_2\text{O}_3) - 411.9 \right)$ - 化简方程:
$793.0 = -1183.2 - \Delta_f G(\text{Al}_2\text{O}_3) + 411.9$
$793.0 = -771.3 - \Delta_f G(\text{Al}_2\text{O}_3)$ - 解方程:
$\Delta_f G(\text{Al}_2\text{O}_3) = -771.3 - 793.0 = -1564.3 \, \text{kJ·mol}^{-1}$