题目
有一反应为 _(2)(101325Pa)+(I)_(2)=2HI(a=1), 试求:-|||-(1)电池表达式-|||-(2)该电池的电动势(35℃时),并根据电动势值判断电池表达式中正、负极是否写对-|||-(3)该反应的 Delta (C)_(1) 值-|||-(4)该反应的平衡常数K值-|||-(5)如果把上述反应改写成-|||-dfrac (1)(2)(H)_(2)(101325Pa)+dfrac (1)(2)(I)_(2)=HI(a=1)-|||-以上各问的答案是否会改变?

题目解答
答案
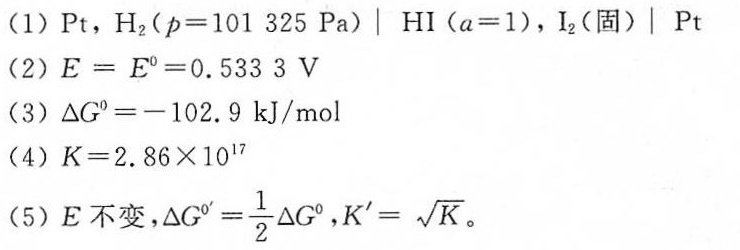
解析
步骤 1:确定电池表达式
根据反应 ${H}_{2}(101325Pa)+{I}_{2}=2HI(a=1)$,可以写出电池表达式为:Pt, ${H}_{2}(p=101325Pa)|HI(a=1)$ ,I2(固)|Pt。其中,Pt为惰性电极,${H}_{2}$在负极发生氧化反应,${I}_{2}$在正极发生还原反应。
步骤 2:计算电池的电动势
根据能斯特方程,电池的电动势 $E$ 可以表示为:$E=E^{0}-\dfrac {RT}{nF}\ln Q$,其中 $E^{0}$ 为标准电动势,$R$ 为气体常数,$T$ 为温度,$n$ 为电子转移数,$F$ 为法拉第常数,$Q$ 为反应商。对于反应 ${H}_{2}(101325Pa)+{I}_{2}=2HI(a=1)$,$E^{0}=0.5333V$,$n=2$,$Q=1$,代入能斯特方程,可以计算出电池的电动势 $E=0.5333V$。根据电动势值判断电池表达式中正、负极写对,因为电动势为正值,说明正极电势高于负极电势,符合电池表达式中正、负极的写法。
步骤 3:计算反应的 $\Delta {G}^{0}$ 值
根据公式 $\Delta {G}^{0}=-nFE^{0}$,代入 $n=2$,$F=96485C/mol$,$E^{0}=0.5333V$,可以计算出反应的 $\Delta {G}^{0}$ 值为 $\Delta {G}^{0}=-102.9kJ/mol$。
步骤 4:计算反应的平衡常数K值
根据公式 $\Delta {G}^{0}=-RT\ln K$,代入 $R=8.314J/(mol\cdot K)$,$T=308K$,$\Delta {G}^{0}=-102.9kJ/mol$,可以计算出反应的平衡常数K值为 $K=2.86\times {10}^{17}$。
步骤 5:分析反应改写后的影响
如果把上述反应改写成 $\dfrac {1}{2}{H}_{2}(101325Pa)+\dfrac {1}{2}{I}_{2}=HI(a=1)$,则电池表达式、电动势、$\Delta {G}^{0}$ 值和平衡常数K值都会发生变化。电池表达式变为:Pt, ${H}_{2}(p=101325Pa)|HI(a=1)$ ,I2(固)|Pt,电动势 $E$ 不变,$\Delta {G}^{0}$ 值变为 $\Delta {G}^{0}=\dfrac {1}{2}\Delta {G}^{0}$,平衡常数K值变为 $K'=\sqrt {K}$。
根据反应 ${H}_{2}(101325Pa)+{I}_{2}=2HI(a=1)$,可以写出电池表达式为:Pt, ${H}_{2}(p=101325Pa)|HI(a=1)$ ,I2(固)|Pt。其中,Pt为惰性电极,${H}_{2}$在负极发生氧化反应,${I}_{2}$在正极发生还原反应。
步骤 2:计算电池的电动势
根据能斯特方程,电池的电动势 $E$ 可以表示为:$E=E^{0}-\dfrac {RT}{nF}\ln Q$,其中 $E^{0}$ 为标准电动势,$R$ 为气体常数,$T$ 为温度,$n$ 为电子转移数,$F$ 为法拉第常数,$Q$ 为反应商。对于反应 ${H}_{2}(101325Pa)+{I}_{2}=2HI(a=1)$,$E^{0}=0.5333V$,$n=2$,$Q=1$,代入能斯特方程,可以计算出电池的电动势 $E=0.5333V$。根据电动势值判断电池表达式中正、负极写对,因为电动势为正值,说明正极电势高于负极电势,符合电池表达式中正、负极的写法。
步骤 3:计算反应的 $\Delta {G}^{0}$ 值
根据公式 $\Delta {G}^{0}=-nFE^{0}$,代入 $n=2$,$F=96485C/mol$,$E^{0}=0.5333V$,可以计算出反应的 $\Delta {G}^{0}$ 值为 $\Delta {G}^{0}=-102.9kJ/mol$。
步骤 4:计算反应的平衡常数K值
根据公式 $\Delta {G}^{0}=-RT\ln K$,代入 $R=8.314J/(mol\cdot K)$,$T=308K$,$\Delta {G}^{0}=-102.9kJ/mol$,可以计算出反应的平衡常数K值为 $K=2.86\times {10}^{17}$。
步骤 5:分析反应改写后的影响
如果把上述反应改写成 $\dfrac {1}{2}{H}_{2}(101325Pa)+\dfrac {1}{2}{I}_{2}=HI(a=1)$,则电池表达式、电动势、$\Delta {G}^{0}$ 值和平衡常数K值都会发生变化。电池表达式变为:Pt, ${H}_{2}(p=101325Pa)|HI(a=1)$ ,I2(固)|Pt,电动势 $E$ 不变,$\Delta {G}^{0}$ 值变为 $\Delta {G}^{0}=\dfrac {1}{2}\Delta {G}^{0}$,平衡常数K值变为 $K'=\sqrt {K}$。