第六章 相平衡6.1 指出下列平衡系统中的组分数C,相数P及自由度数F。(1) I2(s)与其蒸气成平衡;(2) MgCO3(s)与其分解产物MgO(s)和CO2(g)成平衡;(3) NH4Cl(s)放入一抽空的容器中,与其分解产物NH3(g)和HCl (g) 成平衡;(4) 取任意量的NH3(g)和H2S (g)与NH4HS(g)成平衡;(5) 过量的NH4HCO3(s)与其分解产物NH3(g),H2O(g)和CO2(g) 成平衡;(6) I2作为溶质在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。解:(1)C=1,P=2,F l =(-|||-(y -P+2=1;(2)C=2,P=3,F l =(-|||-(y -P+2=1;(3)C=1,P=2,F l =(-|||-(y -P+2=1;(4)C=2,P=2,F l =(-|||-(y -P+2=1;(5)C=1,P=2,F l =(-|||-(y -P+2=1;(6)C=3,P=2,F l =(-|||-(y -P+2=1。6.2常见的Na2CO3(s)水合物有Na2CO3•H2O (s),Na2CO3•7H2O(s)和 Na2CO3•10H2O (s)(1)101.325kPa下,与Na2CO3水溶液及冰平衡共存的水合物最多能有几种?(2)20℃时,与水蒸气平衡共存的水合物最多能可能有几种?解: S=5,R=3,R'=0,C=SRR'=2,F=CP+1=3P,Fmix=0,Pmax=3;(1)已有两相(水溶液、冰),只能有一种水合物与其共存;(2)已有一相(水蒸气),有二种水合物与其共存。F l =(-|||-(y -P+2=16.11 A-B二组分液态部分互溶系统的液-固平衡相图如附图所示,试指出各个项区的平衡关系,各条线所代表的意义,以及三相线所代表的平衡关系。解:单相区:1:A和B的混合溶液l;二相区:2:l1+ l2;3:l2+ B(s);4:l1+ A(s);5:l1+ B(s);6:A(s)+B(s)各条线代表的意义:LJ:A的凝固点降低曲线;JM:B的凝固点降低曲线;NV:B的凝固点降低曲线;MUN:液液相互溶解度曲线。三相线:F l =(-|||-(y -P+2=1MNO:l1+ B(s)F l =(-|||-(y -P+2=1l2;IJK:A(s)+B(s)F l =(-|||-(y -P+2=1l16.13 低温时固态部分互溶、高温时固态完全互溶且具有最低熔点的A-B二组分凝聚系统相图。指出各相区的稳定相及各条线所代表的意义。F l =(-|||-(y -P+2=1解:1区为液态溶液,单相区;2区为固溶体,单相区;3区为液态溶液与固溶体F l =(-|||-(y -P+2=1两相平衡区;4区为液态溶液与固溶体F l =(-|||-(y -P+2=1两相平衡区;5区为固溶体F l =(-|||-(y -P+2=1与固溶体F l =(-|||-(y -P+2=1两相平衡区。最上面边的一条曲线是液相组成线,也是A、B相互溶解度随温度变化曲线;中间的acb线是固溶体组成线,表示不同温度下与液相平衡时固溶体的组成;下面的def线是A(s)与B(s)的相互溶解度曲线,表示不同温度下固溶体F l =(-|||-(y -P+2=1与固溶体F l =(-|||-(y -P+2=1两相平衡时固溶体F l =(-|||-(y -P+2=1与固溶体F l =(-|||-(y -P+2=1的组成。6.14 某二组分凝聚系统相图如附图所示。(1)指出图中各相区的稳定相;(2)绘出图中状态点为a的样品的冷却曲线,并指明冷却过程相变化情况。解:如图:F l =(-|||-(y -P+2=1 F l =(-|||-(y -P+2=16.16 某A-B二组分凝聚系统相图如附图所示。(1)指出各相区稳定存在时的相,三相线上的相平衡关系;(2)绘出图中状态点为a,b,c的样品的冷却曲线,并注明各阶段时的相变化。解:(1)各相区相态如下表所示。相 区相 态相 区相 态12345溶液l固溶体固溶体固溶体溶液l +固溶体6789溶液l + 固溶体溶液l + 固溶体固溶体+ 固溶体固溶体 + 固溶体(2)水平线def为溶液l、固溶体、固溶体三相平衡,自由度数为0。在此线上有下述平衡存在:l(组成为)+(s,组成为)(s,组成为)水平线ghk为溶液l、固溶体F l =(-|||-(y -P+2=1、固溶体F l =(-|||-(y -P+2=1三相平衡,自由度数为0。在此线上有下述平衡存在:l(组成为F l =(-|||-(y -P+2=1)F l =(-|||-(y -P+2=1(s,组成为)+(s,组成为)F l =(-|||-(y -P+2=1(3)状态点为a,b,c三个样品的冷却曲线如下图所示。6.17 某A-B二组分凝聚系统相图如附图。指出各相区的稳定相,三相线上的相平衡关系。解:各相区相态如下表所示。水平线abc为溶液l、溶液l、固溶体三相平衡,自由度数为0。在此线上有下述平衡存在:l(组成为)+(s,组成为)l(s,组成为)水平线def为溶液l、固溶体、固溶体三相平衡,自由度数为0。在此线上有下述平衡存在:l(组成为)(s,组成为)+(s,组成为)6.18 利用下列数据,粗略地描绘出Mg-Cu二组分凝聚系统相图,并标出各区的稳定相。Mg与Cu的熔点分别为648 ℃,1085 ℃。两者可形成两种稳定化合物,MgCu,MgCu,其熔点依次为580℃、800℃。两种金属与两种化合物四者之间形成三种低共熔混合物。低共熔混合物的组成F l =(-|||-(y -P+2=1及低共熔点对应为:35%,380℃;66%,560℃;90.6%,680℃。解:相对原子质量A(Cu)= 63.546,A(Mg)= 24.305。Mg1Cu的组成 F l =(-|||-(y -P+2=1MgCu的组成 F l =(-|||-(y -P+2=1根据题设数据绘制相图如下图所示。⏺各相区相态如下表所示。F l =(-|||-(y -P+2=16.19 某生成不稳定化合物系统液-固平衡相图如附图所示,绘出图中状态点为a,b,c,d,e,的样品的冷却曲线。解:由任一状态点冷却,在单相区时冷却速度是均匀的,当与液相线相交时,固态物质开始析出,由相变热放出,故冷却速度变慢,步冷曲线斜率改变,曲线出现折点。当温度到达三相线温度时,系统三相平衡,自由度f = 0,温度保持不变,冷却曲线出现平台,直至有一个相消失后,温度才可继续下降。状态点为a,b,c,d,e,f,g的样品的冷却曲线如下图所示。F l =(-|||-(y -P+2=16.20 SiO2-AlO系统高温区间的相图示意图如图所示。高温下,SiO有白硅石和鳞石英两种晶型,AB是其转晶线,AB线之上为白硅石,之下为鳞石英。化合物M组成为3SiO•AlO。(1)指出各相区的稳定相及三相线的相平衡关系;(2)绘出图中状态点为a,b,c的样品的冷却曲线。解: 各相区的稳定相:1:l; 2:l +SiO; 3:l +M; 4:SiO(白硅石)+M; 5:SiO(鳞石英)+M;6:l + AlO; 7:M+ AlO。三相线上的相平衡关系:左:SiO+Ml; 右:l + AlOM6.21 某A-B二元凝聚系统相图如附图所示。其中C为不稳定化合物。(1)标出图中各相区的稳定相和自由度;(2)指出图中的三相线及相平衡关系;(3)绘出图中状态点为a,b的样品的冷却曲线,注明冷却过程相变化过程;(4)将5kg处于b点的样品冷却至t,系统中液态物质与析出固态物质的质量各为多少?解:(1)各相区的相态如下表所示。(2)三相线cde上的相平衡:α(s)+C(s)l三相线fgh上的三相平衡:l+β(s)F l =(-|||-(y -P+2=1C(s)(3)冷却曲线如右图:(4)b点的样品冷却至t,l,β(s)两相平衡共存,由图读出两相的组成:w(l)=0.6,w(s)=0.9,而系统点组成为w(b)=0.7。于是,m(l)+m(s)=5kgm(l)=3.33 kg,m(s)=1.67kg6.22 某A-B二组分凝聚系统相图如图所示。标出各相区的稳定相、指出三相线的相平衡关系。解:各相区的相态如下表所示。三相线abc上的三相平衡:溶液(组成为w2)F l =(-|||-(y -P+2=1固溶体α(s)+化合物C3(s)三相线def上的三相平衡:溶液(组成为w)化合物C(s)+不稳定化合物C(s)三相线ghk上的三相平衡:溶液(组成为w)+B(s)不稳定化合物C(s)6.23某A-B二组分凝聚系统相图如图所示。标出各相区的稳定相、指出三相线的相平衡关系。解:各相区的稳定相:1:l;2:l+A;3:A+C;4:l+C;5:C+;6:l+; 7:l+;8:;9:;10:+三相线上的相平衡关系:A. b:A+lF l =(-|||-(y -P+2=1C B. d:C+F l =(-|||-(y -P+2=1l C. f:l+F l =(-|||-(y -P+2=1 D. - E. 二组分凝聚系统相图如图所示。 F. (1)标出各相区的稳定相;指出各三相平衡线的相平衡关系; G. , 是稳定化合物还是不稳定化合物; ,b的样品的冷却曲线,并指明冷却过程相变化情况。 解:(1)各相区的稳定相: ;6:+C; 7:;8:+l;9:+D; ;11:B+D;12:l+B 三相线上的相平衡关系: d:C+F l =(-|||-(y -P+2=1l ef:l1+CF l =(-|||-(y -P+2=1l2 mn:D+BF l =(-|||-(y -P+2=1l 是稳定化合物, 是不稳定化合物; (3)冷却曲线如图 F l =(-|||-(y -P+2=1F l =(-|||-(y -P+2=1 如有侵权请联系告知删除,感谢你们的配合!
第六章 相平衡
6.1 指出下列平衡系统中的组分数C,相数P及自由度数F。
(1) I2(s)与其蒸气成平衡;
(2) MgCO3(s)与其分解产物MgO(s)和CO2(g)成平衡;
(3) NH4Cl(s)放入一抽空的容器中,与其分解产物NH3(g)和HCl (g) 成平衡;
(4) 取任意量的NH3(g)和H2S (g)与NH4HS(g)成平衡;
(5) 过量的NH4HCO3(s)与其分解产物NH3(g),H2O(g)和CO2(g) 成平衡;
(6) I2作为溶质在两不互溶液体H2O和CCl4中达到分配平衡(凝聚系统)。
解:(1)C=1,P=2,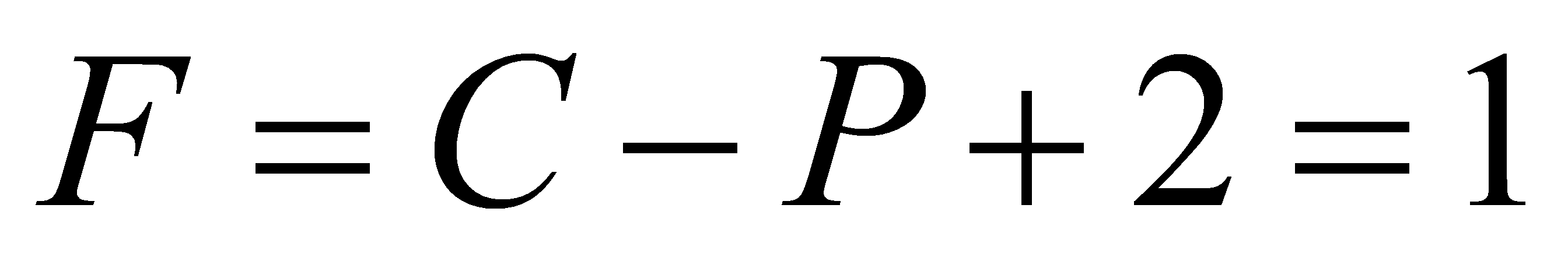 ;
;
(2)C=2,P=3,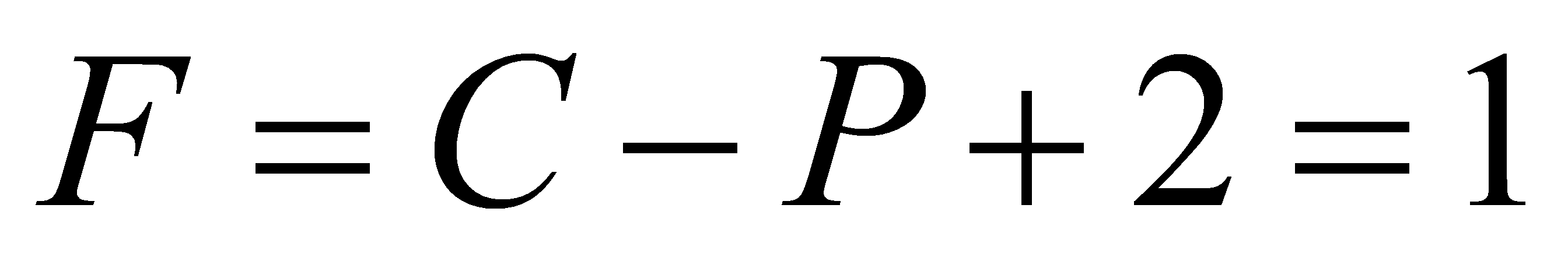 ;
;
(3)C=1,P=2,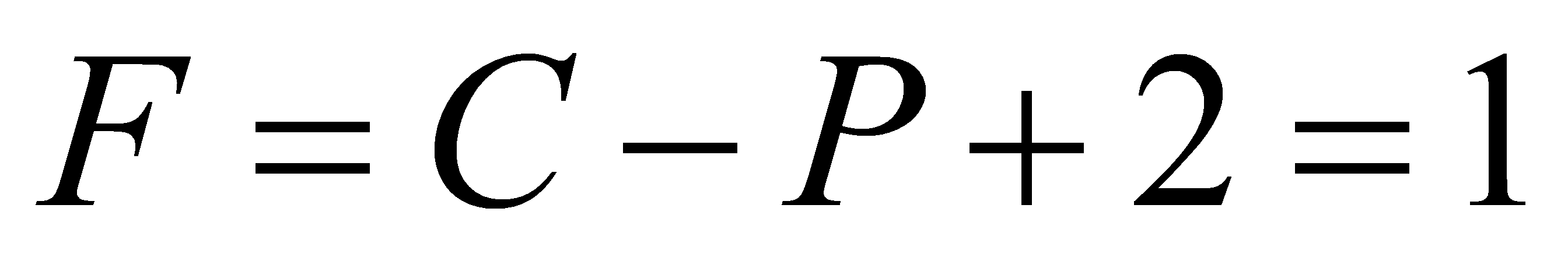 ;
;
(4)C=2,P=2,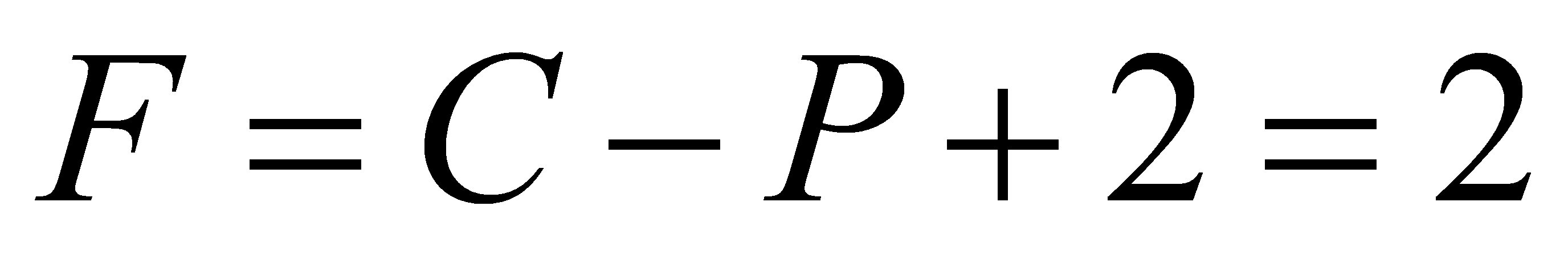 ;
;
(5)C=1,P=2,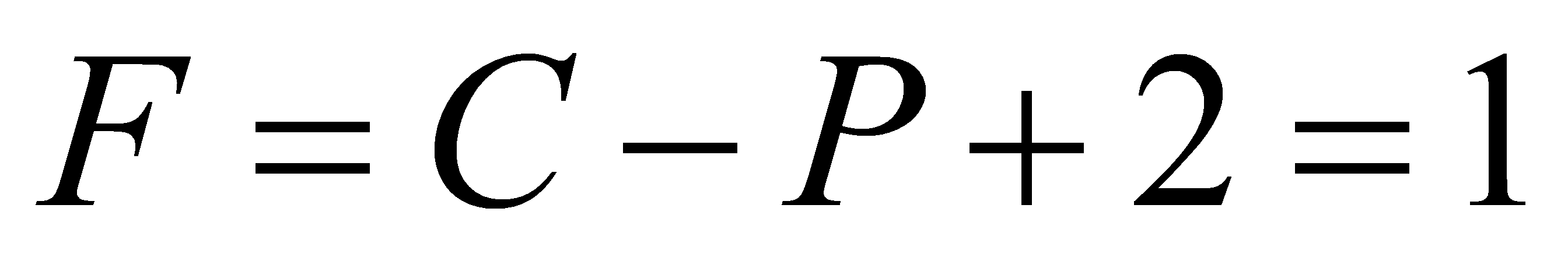 ;
;
(6)C=3,P=2,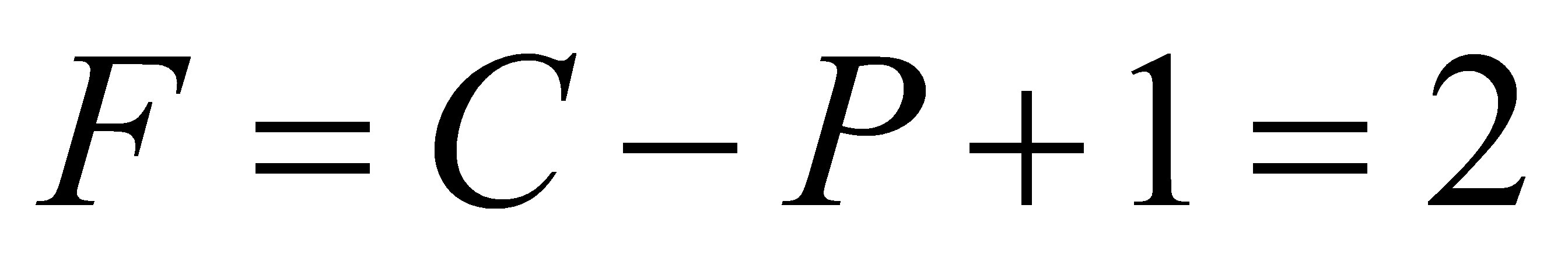 。
。
6.2常见的Na2CO3(s)水合物有Na2CO3•H2O (s),Na2CO3•7H2O(s)和 Na2CO3•10H2O (s)
(1)101.325kPa下,与Na2CO3水溶液及冰平衡共存的水合物最多能有几种?
(2)20℃时,与水蒸气平衡共存的水合物最多能可能有几种?
解: S=5,R=3,R'=0,C=SRR'=2,F=CP+1=3P,Fmix=0,Pmax=3;
(1)已有两相(水溶液、冰),只能有一种水合物与其共存;
(2)已有一相(水蒸气),有二种水合物与其共存。
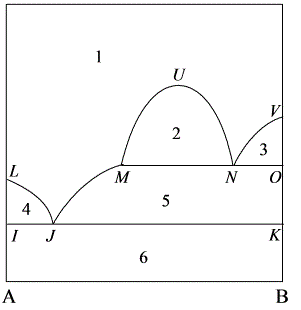 6.11 A-B二组分液态部分互溶系统的液-固平衡相图如附图所示,试指出各个项区的平衡关系,各条线所代表的意义,以及三相线所代表的平衡关系。
6.11 A-B二组分液态部分互溶系统的液-固平衡相图如附图所示,试指出各个项区的平衡关系,各条线所代表的意义,以及三相线所代表的平衡关系。
解:单相区:1:A和B的混合溶液l;
二相区:2:l1+ l2;3:l2+ B(s);4:l1+ A(s);
5:l1+ B(s);6:A(s)+B(s)
各条线代表的意义:
LJ:A的凝固点降低曲线;
JM:B的凝固点降低曲线;
NV:B的凝固点降低曲线;
MUN:液液相互溶解度曲线。
三相线:
 MNO:l1+ B(s)
MNO:l1+ B(s) l2;
l2;
IJK:A(s)+B(s) l1
l1
6.13 低温时固态部分互溶、高温时固态完全互溶且具有最低熔点的A-B二组分凝聚系统相图。指出各相区的稳定相及各条线所代表的意义。
 解:1区为液态溶液,单相区;
解:1区为液态溶液,单相区;
2区为固溶体,单相区;
3区为液态溶液与固溶体 两相平衡区;
两相平衡区;
4区为液态溶液与固溶体 两相平衡区;
两相平衡区;
5区为固溶体 与固溶体
与固溶体 两相平衡区。
两相平衡区。
最上面边的一条曲线是液相组成线,也是A、B相互溶解度随温度变化曲线;
中间的acb线是固溶体组成线,表示不同温度下与液相平衡时固溶体的组成;
下面的def线是A(s)与B(s)的相互溶解度曲线,表示不同温度下固溶体 与固溶体
与固溶体 两相平衡时固溶体
两相平衡时固溶体 与固溶体
与固溶体 的组成。
的组成。
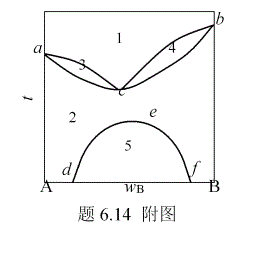
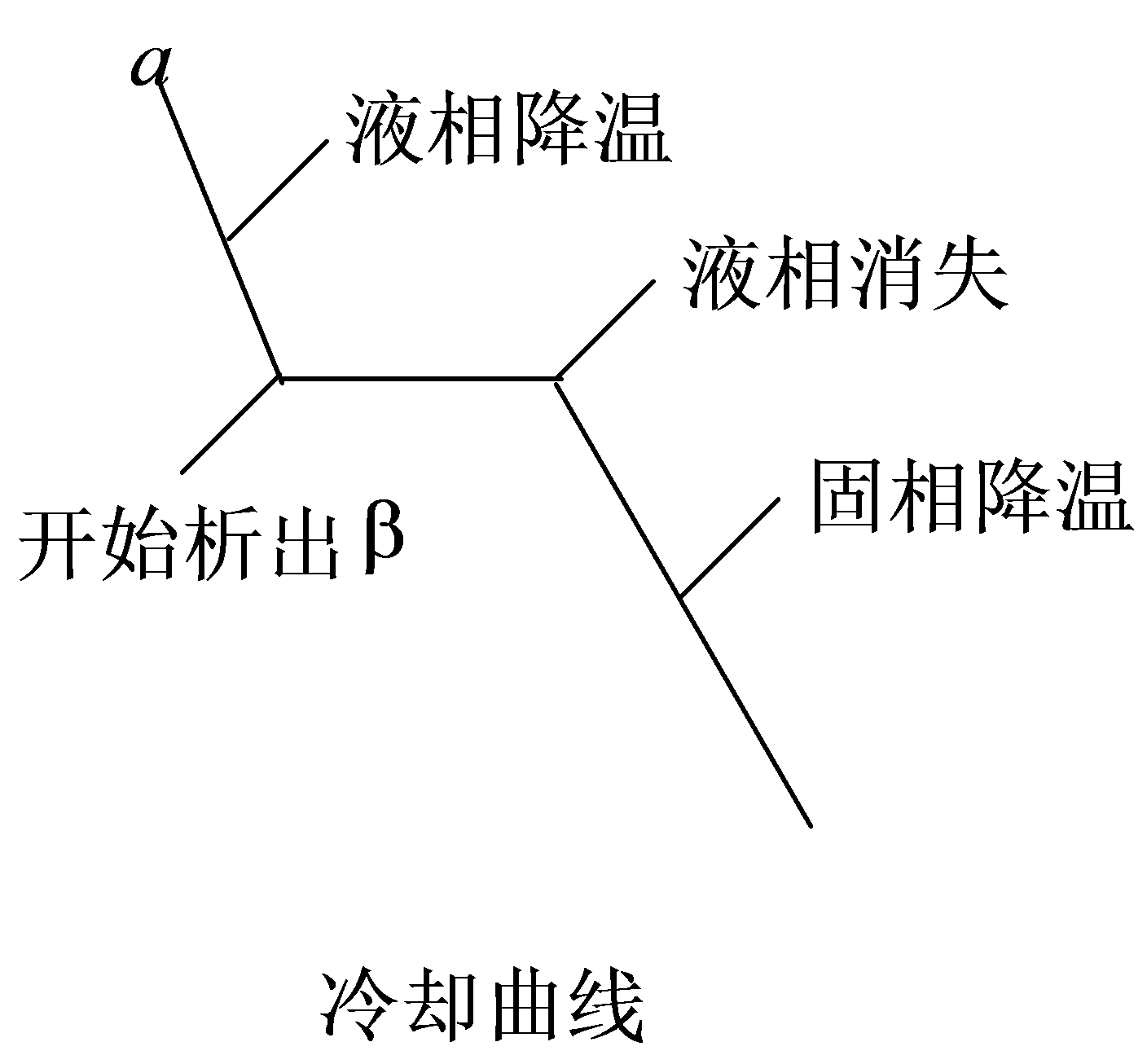
6.14 某二组分凝聚系统相图如附图所示。
(1)指出图中各相区的稳定相;
(2)绘出图中状态点为a的样品的冷却曲线,并指明冷却过程相变化情况。
解:如图:
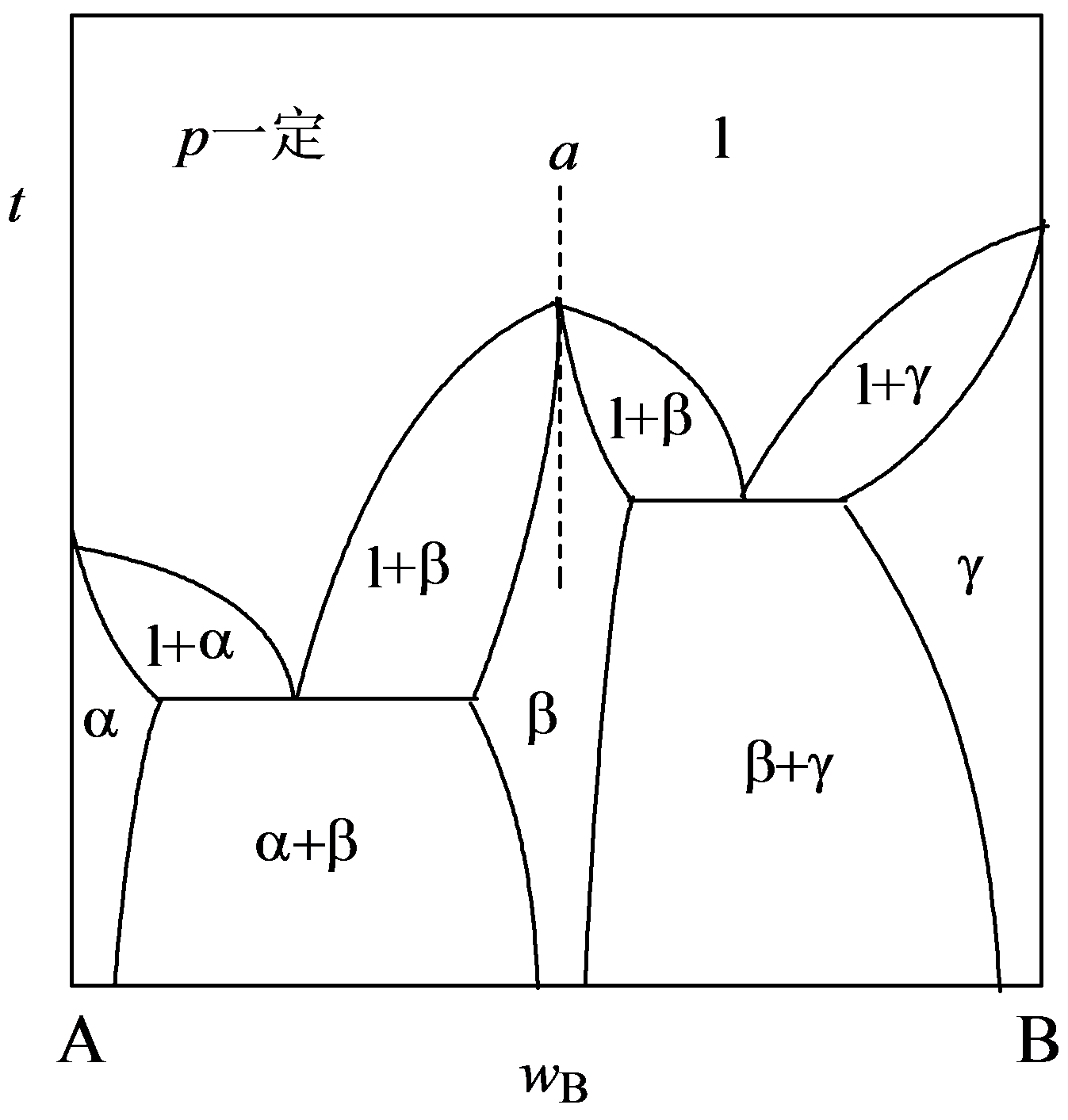
6.16 某A-B二组分凝聚系统相图如附图所示。
(1)指出各相区稳定存在时的相,三相线上的相平衡关系;
(2)绘出图中状态点为a,b,c的样品的冷却曲线,并注明各阶段时的相变化。
解:(1)各相区相态如下表所示。
相 区
相 态
相 区
相 态
1
2
3
4
5
溶液l
固溶体
固溶体
固溶体
溶液l +固溶体
6
7
8
9
溶液l + 固溶体
溶液l + 固溶体
固溶体+ 固溶体
固溶体 + 固溶体
(2)水平线def为溶液l、固溶体、固溶体三相平衡,自由度数为0。在此线上有下述平衡存在:l(组成为)+(s,组成为)(s,组成为)
水平线ghk为溶液l、固溶体 、固溶体
、固溶体 三相平衡,自由度数为0。在此线上有下述平衡存在:l(组成为
三相平衡,自由度数为0。在此线上有下述平衡存在:l(组成为
 )
) (s,组成为)+(s,组成为)
(s,组成为)+(s,组成为)
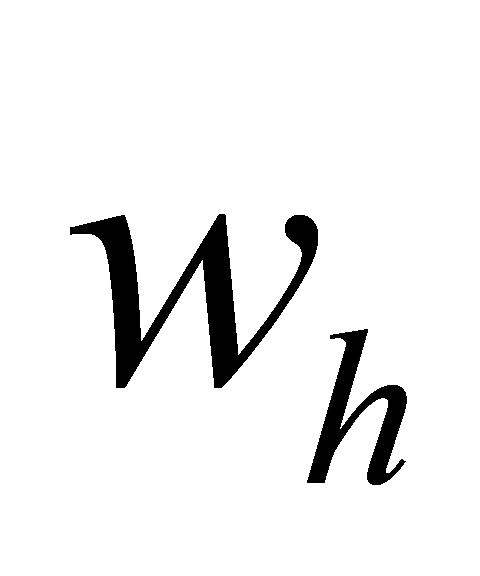 (3)状态点为a,b,c三个样品的冷却曲线如下图所示。
(3)状态点为a,b,c三个样品的冷却曲线如下图所示。
6.17 某A-B二组分凝聚系统相图如附图。指出各相区的稳定相,三相线上的相平衡关系。
解:各相区相态如下表所示。
水平线abc为溶液l、溶液l、固溶体三相平衡,
自由度数为0。在此线上有下述平衡存在:
l(组成为)+(s,组成为)l(s,组成为)
水平线def为溶液l、固溶体、固溶体三相平衡,
自由度数为0。在此线上有下述平衡存在:
l(组成为)(s,组成为)+(s,组成为)
6.18 利用下列数据,粗略地描绘出Mg-Cu二组分凝聚系统相图,并标出各区的稳定相。Mg与Cu的熔点分别为648 ℃,1085 ℃。两者可形成两种稳定化合物,MgCu,MgCu,其熔点依次为580℃、800℃。两种金属与两种化合物四者之间形成三种低共熔混合物。低共熔混合物的组成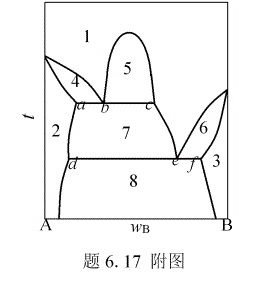 及低共熔点对应为:35%,380℃;66%,560℃;90.6%,680℃。
及低共熔点对应为:35%,380℃;66%,560℃;90.6%,680℃。
解:相对原子质量A(Cu)= 63.546,A(Mg)= 24.305。
Mg1Cu的组成 
MgCu的组成
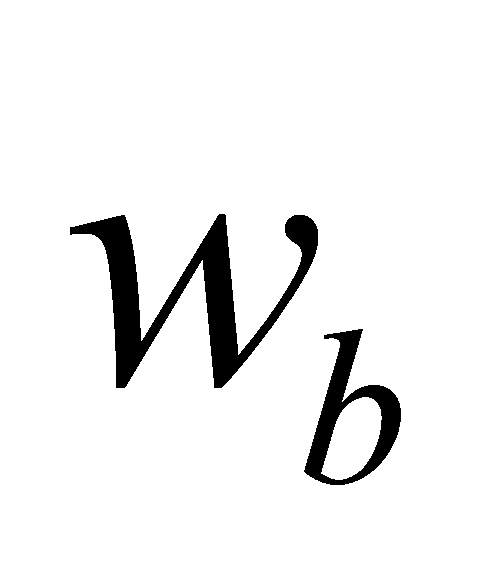 根据题设数据绘制相图如下图所示。
根据题设数据绘制相图如下图所示。
⏺
各相区相态如下表所示。
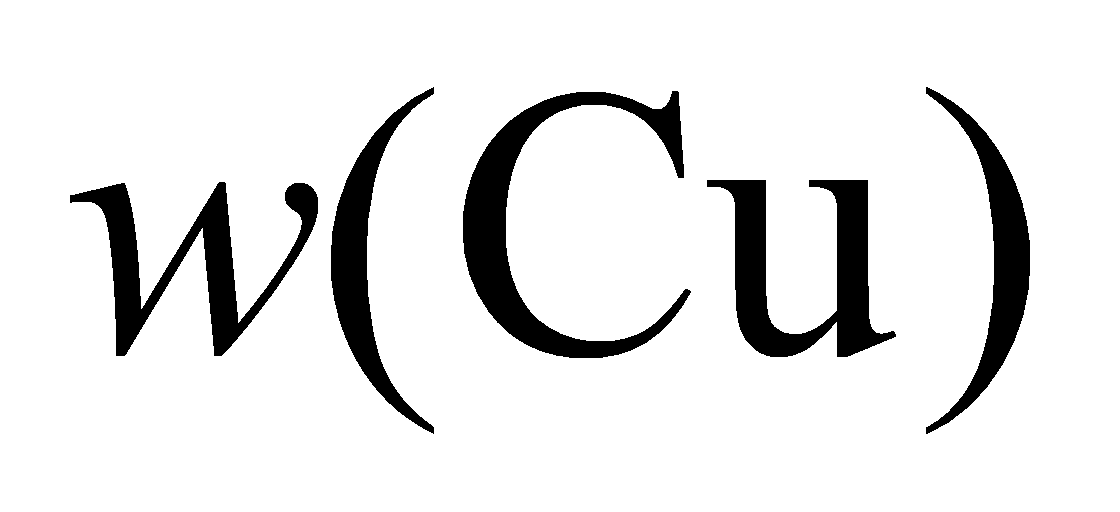 6.19 某生成不稳定化合物系统液-固平衡相图如附图所示,绘出图中状态点为a,b,c,d,e,的样品的冷却曲线。
6.19 某生成不稳定化合物系统液-固平衡相图如附图所示,绘出图中状态点为a,b,c,d,e,的样品的冷却曲线。
解:由任一状态点冷却,在单相区时冷却速度是均匀的,当与液相线相交时,固态物质开始析出,由相变热放出,故冷却速度变慢,步冷曲线斜率改变,曲线出现折点。当温度到达三相线温度时,系统三相平衡,自由度f = 0,温度保持不变,冷却曲线出现平台,直至有一个相消失后,温度才可继续下降。状态点为a,b,c,d,e,f,g的样品的冷却曲线如下图所示。
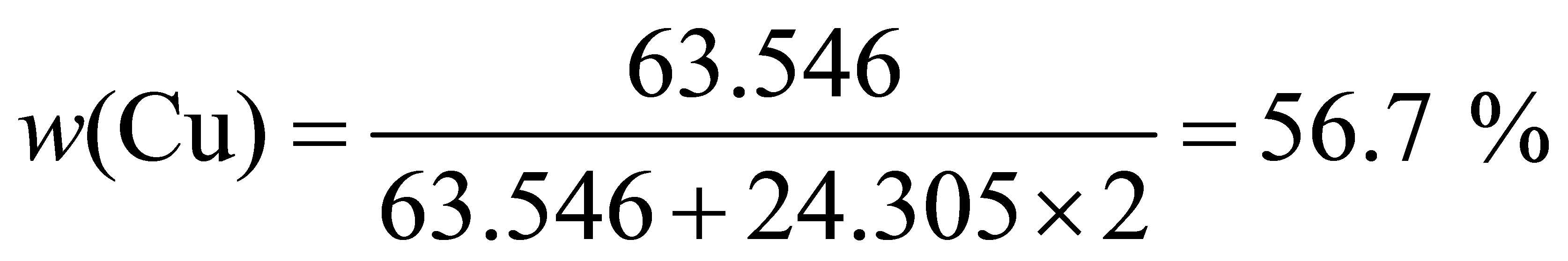
6.20 SiO2-AlO系统高温区间的相图示意图如图所示。高温下,SiO有白硅石和鳞石英两种晶型,AB是其转晶线,AB线之上为白硅石,之下为鳞石英。化合物M组成为3SiO•AlO。
(1)指出各相区的稳定相及三相线的相平衡关系;
(2)绘出图中状态点为a,b,c的样品的冷却曲线。
解:
各相区的稳定相:
1:l; 2:l +SiO; 3:l +M; 4:SiO(白硅石)+M; 5:SiO(鳞石英)+M;
6:l + AlO; 7:M+ AlO。
三相线上的相平衡关系:
左:SiO+Ml; 右:l + AlOM
6.21 某A-B二元凝聚系统相图如附图所示。其中C为不稳定化合物。
(1)标出图中各相区的稳定相和自由度;
(2)指出图中的三相线及相平衡关系;
(3)绘出图中状态点为a,b的样品的冷却曲线,注明冷却过程相变化过程;
(4)将5kg处于b点的样品冷却至t,系统中液态物质与析出固态物质的质量各为多少?
解:(1)各相区的相态如下表所示。
(2)三相线cde上的相平衡:α(s)+C(s)l
三相线fgh上的三相平衡:l+β(s)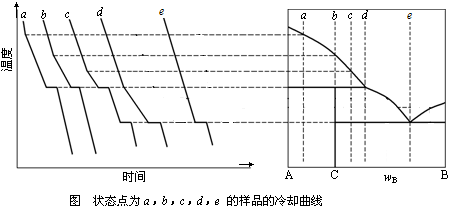 C(s)
C(s)
(3)冷却曲线如右图:
(4)b点的样品冷却至t,l,β(s)两相平衡共存,由图读出两相的组成:
w(l)=0.6,w(s)=0.9,而系统点组成为w(b)=0.7。于是
,m(l)+m(s)=5kg
m(l)=3.33 kg,m(s)=1.67kg
6.22 某A-B二组分凝聚系统相图如图所示。标出各相区的稳定相、指出三相线的相平衡关系。
解:各相区的相态如下表所示。
三相线abc上的三相平衡:
溶液(组成为w2)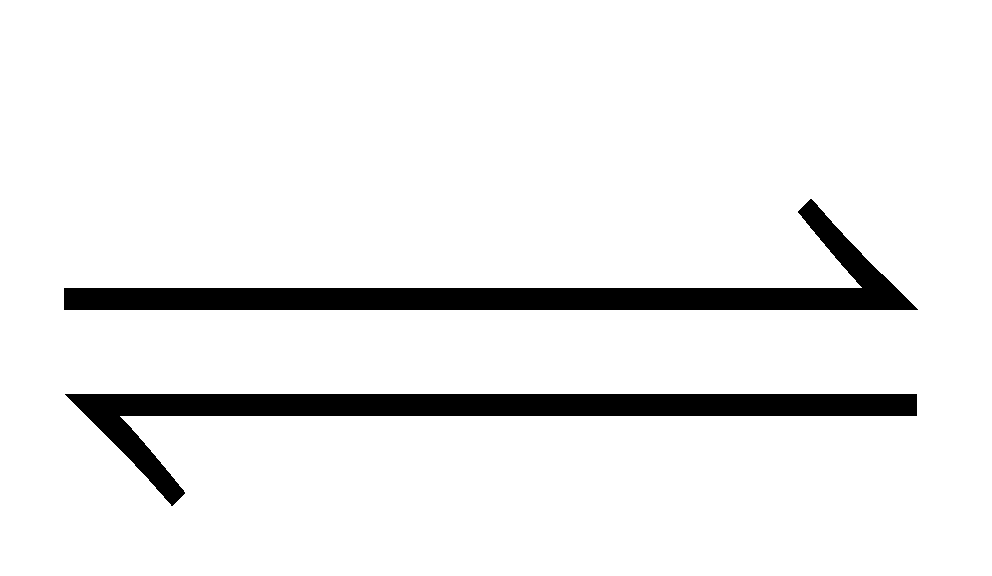 固溶体α(s)+化合物C3(s)
固溶体α(s)+化合物C3(s)
三相线def上的三相平衡:
溶液(组成为w)化合物C(s)+不稳定化合物C(s)
三相线ghk上的三相平衡:
溶液(组成为w)+B(s)不稳定化合物C(s)
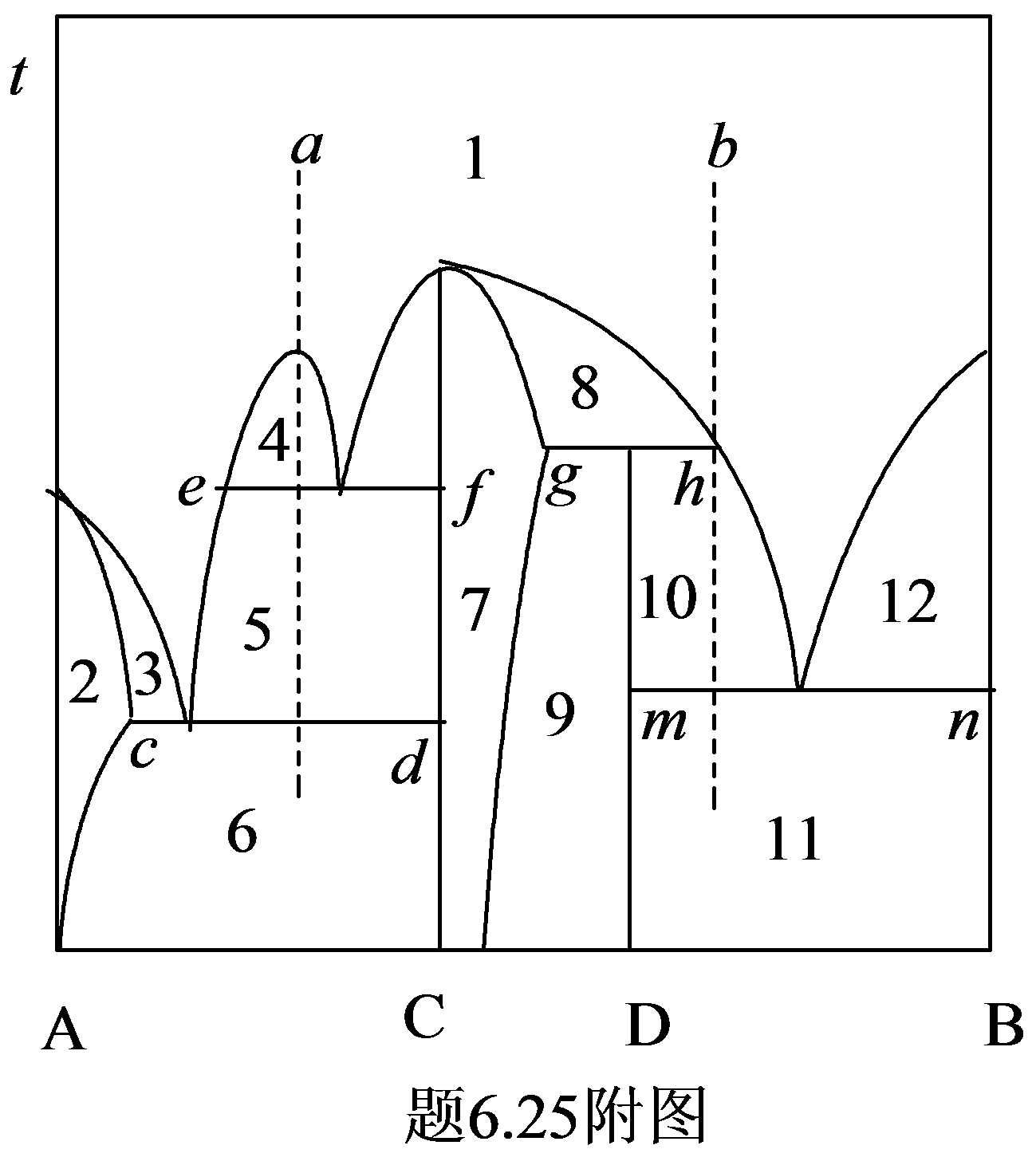
6.23某A-B二组分凝聚系统相图如图所示。标出各相区的稳定相、指出三相线的相平衡关系。
解:各相区的稳定相:
1:l;2:l+A;3:A+C;4:l+C;5:C+;
6:l+; 7:l+;8:;9:;10:+
三相线上的相平衡关系:
A. b:A+l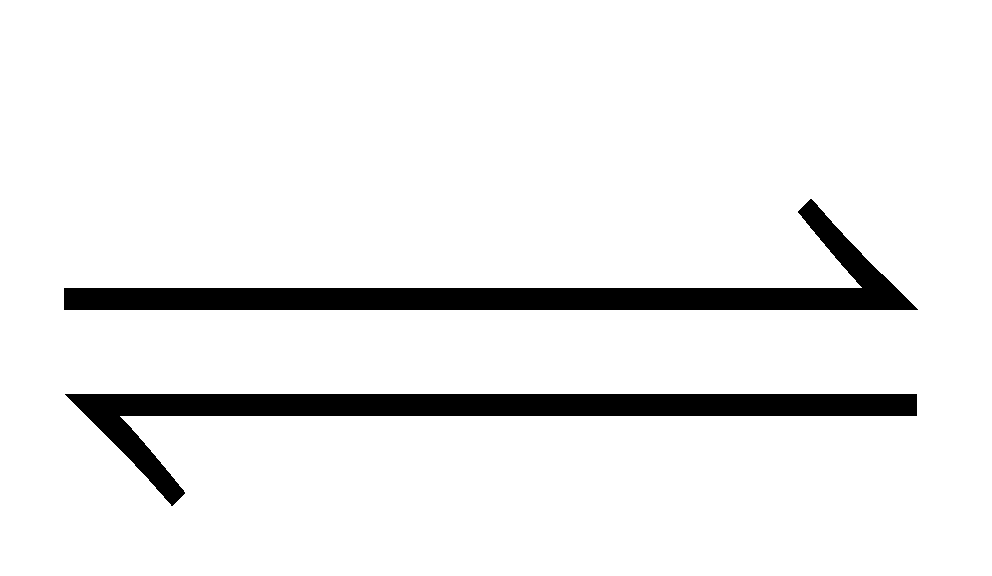 C
CB. d:C+
 l
lC. f:l+
D. -
E. 二组分凝聚系统相图如图所示。
F. (1)标出各相区的稳定相;指出各三相平衡线的相平衡关系;
G. ,
是稳定化合物还是不稳定化合物;
,b的样品的冷却曲线,并指明冷却过程相变化情况。
解:(1)各相区的稳定相:
;6:+C; 7:;8:+l;9:+D;
;11:B+D;12:l+B
三相线上的相平衡关系:
d:C+
 l ef:l1+C
l ef:l1+C l2
l2mn:D+B
 l
l是稳定化合物,
是不稳定化合物;
(3)冷却曲线如图
如有侵权请联系告知删除,感谢你们的配合!
题目解答
答案
6.25