题目
1.判断正误(正确的打"√",错误的打"×")。-|||-(1)常温下,铁、铝容器能盛放浓H2SO 4、浓HNO3。-|||-()-|||-(2)稀H2SO4具有吸水性,可使蔗糖炭化。 ()-|||-(3)浓H2SO4、浓HNO3都具有强氧化性。 ()-|||-(4)久置的浓HNO3常显黄色,是因为含有 ^3+ 的原因。-|||-()-|||-(5)浓H2SO4、浓HNO3与铜反应时,都表现出氧化性和-|||-酸性。 ()-|||-(6)加热条件下,1 mol Cu和2mol浓H2 SO4恰好完全-|||-反应。 ()-|||-(7)常温下,铁制容器可以盛装浓HNO3,不可以盛装稀-|||-HNO3,说明稀HN O3的氧化性比浓HNO3强。 () ()-|||-(8)浓H2 SO4、浓HNO3与碳单质反应时,都只表现氧-|||-化性。 ()-|||-(9)浓H2SO4、浓HNO3滴加到紫色石蕊试纸上,现象都-|||-是先变红后变白。 ()-|||-(10)酸化KMnO4时,既可以加浓H2S O4也可以加浓-|||-HNO3。 ()

题目解答
答案
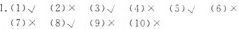
解析
步骤 1:常温下,铁、铝容器能盛放浓H2SO4、浓HNO3。
常温下,铁和铝在浓硫酸和浓硝酸中会发生钝化,形成一层致密的氧化膜,阻止进一步反应,因此可以盛放。
步骤 2:稀H2SO4具有吸水性,可使蔗糖炭化。
稀硫酸不具有吸水性,浓硫酸具有吸水性,可使蔗糖炭化。
步骤 3:浓H2SO4、浓HNO3都具有强氧化性。
浓硫酸和浓硝酸都具有强氧化性。
步骤 4:久置的浓HNO3常显黄色,是因为含有 ${Fe}^{3+}$ 的原因。
久置的浓硝酸常显黄色,是因为硝酸分解产生的二氧化氮溶解在其中,不是因为含有 ${Fe}^{3+}$。
步骤 5:浓H2SO4、浓HNO3与铜反应时,都表现出氧化性和酸性。
浓硫酸和浓硝酸与铜反应时,都表现出氧化性和酸性。
步骤 6:加热条件下,1 mol Cu和2mol浓H2SO4恰好完全反应。
铜与浓硫酸反应时,硫酸过量,铜不足,因此1 mol Cu和2mol浓H2SO4不能恰好完全反应。
步骤 7:常温下,铁制容器可以盛装浓HNO3,不可以盛装稀HNO3,说明稀HNO3的氧化性比浓HNO3强。
常温下,铁在浓硝酸中发生钝化,而在稀硝酸中可以反应,说明稀硝酸的氧化性比浓硝酸强。
步骤 8:浓H2SO4、浓HNO3与碳单质反应时,都只表现氧化性。
浓硫酸和浓硝酸与碳单质反应时,都只表现氧化性。
步骤 9:浓H2SO4、浓HNO3滴加到紫色石蕊试纸上,现象都是先变红后变白。
浓硫酸和浓硝酸滴加到紫色石蕊试纸上,现象都是先变红后变白。
步骤 10:酸化KMnO4时,既可以加浓H2SO4也可以加浓HNO3。
酸化KMnO4时,只能加浓硫酸,不能加浓硝酸,因为硝酸会与高锰酸钾反应。
常温下,铁和铝在浓硫酸和浓硝酸中会发生钝化,形成一层致密的氧化膜,阻止进一步反应,因此可以盛放。
步骤 2:稀H2SO4具有吸水性,可使蔗糖炭化。
稀硫酸不具有吸水性,浓硫酸具有吸水性,可使蔗糖炭化。
步骤 3:浓H2SO4、浓HNO3都具有强氧化性。
浓硫酸和浓硝酸都具有强氧化性。
步骤 4:久置的浓HNO3常显黄色,是因为含有 ${Fe}^{3+}$ 的原因。
久置的浓硝酸常显黄色,是因为硝酸分解产生的二氧化氮溶解在其中,不是因为含有 ${Fe}^{3+}$。
步骤 5:浓H2SO4、浓HNO3与铜反应时,都表现出氧化性和酸性。
浓硫酸和浓硝酸与铜反应时,都表现出氧化性和酸性。
步骤 6:加热条件下,1 mol Cu和2mol浓H2SO4恰好完全反应。
铜与浓硫酸反应时,硫酸过量,铜不足,因此1 mol Cu和2mol浓H2SO4不能恰好完全反应。
步骤 7:常温下,铁制容器可以盛装浓HNO3,不可以盛装稀HNO3,说明稀HNO3的氧化性比浓HNO3强。
常温下,铁在浓硝酸中发生钝化,而在稀硝酸中可以反应,说明稀硝酸的氧化性比浓硝酸强。
步骤 8:浓H2SO4、浓HNO3与碳单质反应时,都只表现氧化性。
浓硫酸和浓硝酸与碳单质反应时,都只表现氧化性。
步骤 9:浓H2SO4、浓HNO3滴加到紫色石蕊试纸上,现象都是先变红后变白。
浓硫酸和浓硝酸滴加到紫色石蕊试纸上,现象都是先变红后变白。
步骤 10:酸化KMnO4时,既可以加浓H2SO4也可以加浓HNO3。
酸化KMnO4时,只能加浓硫酸,不能加浓硝酸,因为硝酸会与高锰酸钾反应。