题目
求指导本题解题过程,谢谢您!3.14 计算在1000℃时下列碳酸钙分解反应的K°,并判断反应在标准状态下能否自-|||-发进行。-|||-(O)_(3)(s)= CaO(s) + CO2(g )-|||-(Delta )_(1)(H)_(m)^theta /(kJcdot (mol)^-1) -1206.9 -635.09 -393.51-|||-({S)_(m)}^theta /(Jcdot (K)^-1cdot (mol)^-1) 92.9 39.75 213.6
求指导本题解题过程,谢谢您!
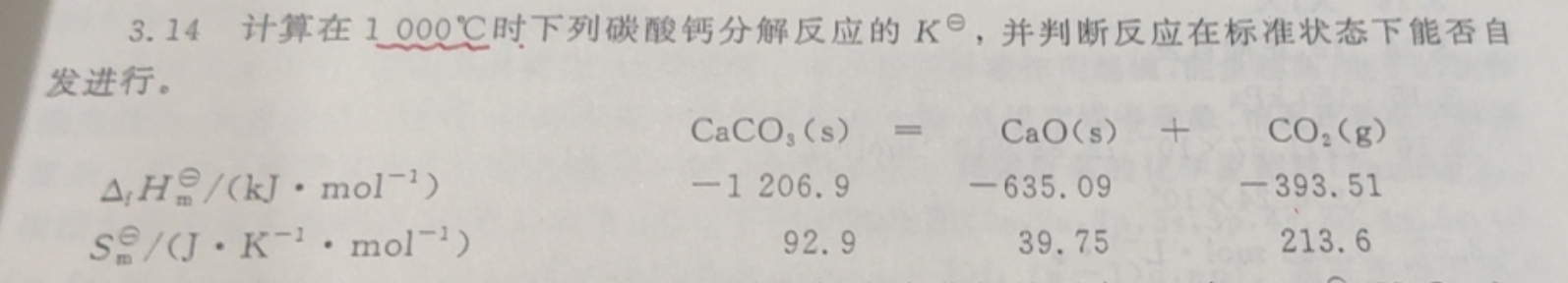
题目解答
答案

解析
步骤 1:计算反应的焓变(ΔH°)
根据题目给出的焓变数据,计算反应的焓变(ΔH°)。
\[
\Delta H° = \Delta H°_{\text{生成物}} - \Delta H°_{\text{反应物}}
\]
\[
\Delta H° = \Delta H°_{\text{CaO(s)}} + \Delta H°_{\text{CO2(g)}} - \Delta H°_{\text{CaCO3(s)}}
\]
\[
\Delta H° = (-635.09) + (-393.51) - (-1206.9) = 178.3 \text{ kJ/mol}
\]
步骤 2:计算反应的熵变(ΔS°)
根据题目给出的熵变数据,计算反应的熵变(ΔS°)。
\[
\Delta S° = \Delta S°_{\text{生成物}} - \Delta S°_{\text{反应物}}
\]
\[
\Delta S° = \Delta S°_{\text{CaO(s)}} + \Delta S°_{\text{CO2(g)}} - \Delta S°_{\text{CaCO3(s)}}
\]
\[
\Delta S° = 39.75 + 213.6 - 92.9 = 160.45 \text{ J/mol·K}
\]
步骤 3:计算反应的吉布斯自由能变(ΔG°)
根据吉布斯自由能变的公式,计算反应的吉布斯自由能变(ΔG°)。
\[
\Delta G° = \Delta H° - T \Delta S°
\]
\[
T = 1000℃ = 1273.15 \text{ K}
\]
\[
\Delta G° = 178.3 \times 10^3 \text{ J/mol} - 1273.15 \text{ K} \times 160.45 \text{ J/mol·K}
\]
\[
\Delta G° = 178300 \text{ J/mol} - 204368.7 \text{ J/mol} = -26068.7 \text{ J/mol}
\]
步骤 4:计算反应的平衡常数(K°)
根据吉布斯自由能变与平衡常数的关系,计算反应的平衡常数(K°)。
\[
\Delta G° = -RT \ln K°
\]
\[
\ln K° = -\frac{\Delta G°}{RT}
\]
\[
\ln K° = -\frac{-26068.7 \text{ J/mol}}{8.314 \text{ J/mol·K} \times 1273.15 \text{ K}}
\]
\[
\ln K° = 2.52
\]
\[
K° = e^{2.52} = 12.4
\]
步骤 5:判断反应在标准状态下能否自发进行
根据ΔG°的值判断反应在标准状态下能否自发进行。
\[
\Delta G° < 0
\]
反应在标准状态下能自发进行。
根据题目给出的焓变数据,计算反应的焓变(ΔH°)。
\[
\Delta H° = \Delta H°_{\text{生成物}} - \Delta H°_{\text{反应物}}
\]
\[
\Delta H° = \Delta H°_{\text{CaO(s)}} + \Delta H°_{\text{CO2(g)}} - \Delta H°_{\text{CaCO3(s)}}
\]
\[
\Delta H° = (-635.09) + (-393.51) - (-1206.9) = 178.3 \text{ kJ/mol}
\]
步骤 2:计算反应的熵变(ΔS°)
根据题目给出的熵变数据,计算反应的熵变(ΔS°)。
\[
\Delta S° = \Delta S°_{\text{生成物}} - \Delta S°_{\text{反应物}}
\]
\[
\Delta S° = \Delta S°_{\text{CaO(s)}} + \Delta S°_{\text{CO2(g)}} - \Delta S°_{\text{CaCO3(s)}}
\]
\[
\Delta S° = 39.75 + 213.6 - 92.9 = 160.45 \text{ J/mol·K}
\]
步骤 3:计算反应的吉布斯自由能变(ΔG°)
根据吉布斯自由能变的公式,计算反应的吉布斯自由能变(ΔG°)。
\[
\Delta G° = \Delta H° - T \Delta S°
\]
\[
T = 1000℃ = 1273.15 \text{ K}
\]
\[
\Delta G° = 178.3 \times 10^3 \text{ J/mol} - 1273.15 \text{ K} \times 160.45 \text{ J/mol·K}
\]
\[
\Delta G° = 178300 \text{ J/mol} - 204368.7 \text{ J/mol} = -26068.7 \text{ J/mol}
\]
步骤 4:计算反应的平衡常数(K°)
根据吉布斯自由能变与平衡常数的关系,计算反应的平衡常数(K°)。
\[
\Delta G° = -RT \ln K°
\]
\[
\ln K° = -\frac{\Delta G°}{RT}
\]
\[
\ln K° = -\frac{-26068.7 \text{ J/mol}}{8.314 \text{ J/mol·K} \times 1273.15 \text{ K}}
\]
\[
\ln K° = 2.52
\]
\[
K° = e^{2.52} = 12.4
\]
步骤 5:判断反应在标准状态下能否自发进行
根据ΔG°的值判断反应在标准状态下能否自发进行。
\[
\Delta G° < 0
\]
反应在标准状态下能自发进行。