题目
22.下列溶液中pH最大的是-|||-A. .1molcdot (L)^-1HCl B. .1molcdot (L)^-1(H)_(3)P(O)_(4) C. .1molcdot (L)^-1HAC-|||-D. .1molcdot (L)^-1NaOH E. .1molcdot (L)^-1 氨水
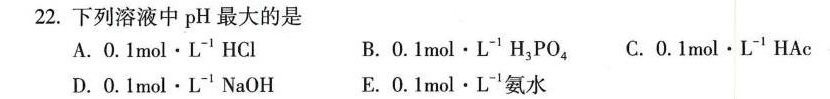
题目解答
答案
解析
本题考查不同浓度溶液的pH比较,需掌握强酸、强碱、弱酸、弱碱及盐溶液的pH特点。关键点在于:
- 强酸、强碱完全电离,pH由浓度直接决定;
- 弱酸、弱碱部分电离,pH需通过解离度计算;
- 多元弱酸主要以第一步解离为主;
- 强碱溶液的pH最大,因浓度相同条件下,强碱溶液的OH⁻浓度最高。
选项分析
A. $0.1\ \mathrm{mol\cdot L^{-1}}\ \mathrm{HCl}$
- 强酸完全电离,$[\mathrm{H}^+] = 0.1\ \mathrm{mol\cdot L^{-1}}$,$\mathrm{pH} = 1$。
B. $0.1\ \mathrm{mol\cdot L^{-1}}\ \mathrm{H_3PO_4}$
- 弱酸(多元酸第一步解离为主),$\mathrm{Ka_1} = 7.5 \times 10^{-3}$。
- 解离度 $\alpha = \sqrt{\frac{\mathrm{Ka}}{c}} = \sqrt{\frac{7.5 \times 10^{-3}}{0.1}} \approx 0.274$,$[\mathrm{H}^+] \approx 0.0274\ \mathrm{mol\cdot L^{-1}}$,$\mathrm{pH} \approx 1.56$。
C. $0.1\ \mathrm{mol\cdot L^{-1}}\ \mathrm{HAc}$
- 弱酸,$\mathrm{Ka} = 1.8 \times 10^{-5}$。
- $[\mathrm{H}^+] = \sqrt{c \cdot \mathrm{Ka}} = \sqrt{0.1 \cdot 1.8 \times 10^{-5}} \approx 0.00134\ \mathrm{mol\cdot L^{-1}}$,$\mathrm{pH} \approx 2.88$。
D. $0.1\ \mathrm{mol\cdot L^{-1}}\ \mathrm{NaOH}$
- 强碱完全电离,$[\mathrm{OH}^-] = 0.1\ \mathrm{mol\cdot L^{-1}}$,$\mathrm{pH} = 14 - \mathrm{pOH} = 14 - 1 = 13$。
E. $0.1\ \mathrm{mol\cdot L^{-1}}\ \text{氨水}$
- 弱碱,$\mathrm{Kb} = 1.8 \times 10^{-5}$。
- $[\mathrm{OH}^-] = \sqrt{c \cdot \mathrm{Kb}} = \sqrt{0.1 \cdot 1.8 \times 10^{-5}} \approx 0.00134\ \mathrm{mol\cdot L^{-1}}$,$\mathrm{pOH} \approx 2.88$,$\mathrm{pH} \approx 11.12$。
结论
强碱溶液pH最大,故选D。