题目
4 -17 已知CaF2溶解度为 times (10)^-4molcdot (L)^-1 ,求其溶度积K
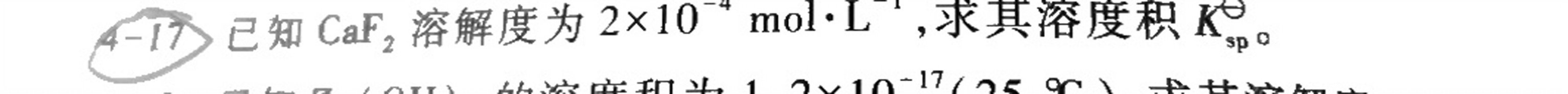
题目解答
答案

解析
本题考查难溶电解质溶度积$K_{sp}$的计算,关键是根据溶解度推导离子浓度,再代入溶度积公式计算。
步骤1:写出$CaF_2$的溶解平衡方程式
$CaF_2$是难溶电解质,在水溶液中存在溶解平衡:
$CaF_2(s) \rightleftharpoons Ca^{2+}(aq) + 2F^-(aq)$
由方程式可知:1 mol $CaF_2$溶解生成1 mol $Ca^{2+}$和2 mol $F^-$。
步骤2:根据溶解度计算离子浓度
已知$CaF_2$的溶解度$s = 2 \times 10^{-4} \, mol \cdot L^{-1}$,则:
- $c(Ca^{2+}) = s = 2 \times 10^{-4} \, mol \cdot L^{-1}$(1:1对应)
- $c(F^-) = 2s = 2 \times (2 \times 10^{-4}) = 4 \times 10^{-4} \, mol \cdot L^{-1}$(1:2对应)
步骤3:代入溶度积公式计算$K_{sp}$
溶度积表达式为:
$K_{sp} = c(Ca^{2+}) \cdot [c(F^-)]^2$
代入数据:
$K_{sp} = (2 \times 10^{-4}) \times (4 \times 10^{-4})^2$
$= (2 \times 10^{-4}) \times (16 \times 10^{-8})$
$= 32 \times 10^{-12} = 3.2 \times 10^{-11}$