在298K时,将Fe3+/Fe2+电极和Ag+/Ag电极构成原电池。已知phi;0Fe3+/Fe2+=0.771V,phi;0Ag+/Ag=0.799V,[Fe3+]=1.00molmiddot;L-1,[Fe2+]=0.01molmiddot;L-1,[Ag+]=1.00molmiddot;L-1, (1)计算原电池的电动势,写出原电池符号; (2)写出电池反应,并计算其平衡常数。
在298K时,将Fe3+/Fe2+电极和Ag+/Ag电极构成原电池。已知phi;0Fe3+/Fe2+=0.771V,phi;0Ag+/Ag=0.799V,[Fe3+]=1.00molmiddot;L-1,[Fe2+]=0.01molmiddot;L-1,[Ag+]=1.00molmiddot;L-1, (1)计算原电池的电动势,写出原电池符号; (2)写出电池反应,并计算其平衡常数。
题目解答
答案
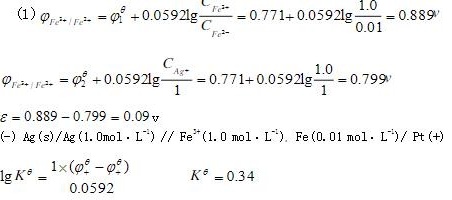
解析
题目考察知识
本题主要考察原电池电动势计算、原电池符号书写、电池反应方程式书写及平衡常数计算,涉及能斯特方程和电极电势的应用。
(1)原电池电动势计算及符号书写
步骤1:计算各电极的电极电势
电极电势公式为能斯特方程:
$\phi = \phi^\circ + \frac{0.0592}{n} \lg \frac{[\text{氧化态}]}{[\text{还原态}]}$
-
Fe³⁺/Fe²⁺电极:
$\phi^\circ_{\text{Fe³⁺/Fe²⁺}} = 0.771\,\text{V}$,$n=1$,$[\text{Fe³⁺}]=1.00\,\text{mol/L}$,$[\text{Fe²⁺}]=0.01\,\text{mol/L}$
$\phi_{\text{Fe³⁺/Fe²⁺}} = 0.771 + \frac{0.0592}{1} \lg \frac{1.00}{0.01} = 0.771 + 0.0592 \times 2 = 0.889\,\text{V}$ -
Ag⁺/Ag电极:
$\phi^\circ_{\text{Ag⁺/Ag}} = 0.799\,\text{V}$,$n=1$,$[\text{Ag⁺}]=1.00\,\text{mol/L}$
$\phi_{\text{Ag⁺/Ag}} = 0.799 + \frac{0.0592}{1} \lg 1.00 = 0.799\,\text{V}$
步骤2:确定正负极及电动势
电极电势高的为正极(Fe³⁺/Fe²⁺),低的为负极(Ag⁺/Ag)。电动势:
$\varepsilon = \phi_{\text{正极}} - \phi_{\text{负极}} = 0.889 - 0.799 = 0.10\,\text{V}$
步骤3:原电池符号
负极(氧化)写左边,正极(还原)写右边,盐桥用“||”分隔:
$\text{Ag(s)} \mid \text{Ag}^+(1.00\,\text{mol/L}) \parallel \text{Fe}^{3+}(1.00\,\text{mol/L}),\text{Fe}^{2+}(0.01\,\text{mol/L}) \mid \text{Pt(s)}$
(2)电池反应及平衡常数计算
步骤1:电池反应方程式
负极氧化:$\text{Ag(s)} \rightarrow \text{Ag}^+ + e^-$
正极还原:$\text{Fe}^{3+} + e^- \rightarrow \text{Fe}^{2+}$
总反应:$\text{Ag(s)} + \text{Fe}^{3+} \rightarrow \text{Ag}^+ + \text{Fe}^{2+}$
步骤2:平衡常数计算
平衡常数公式:$\lg K^\theta = \frac{n(\phi^\circ_{\text{正}} - \phi^\circ_{\text{负}})}{0.0592}$
$n=1$,$\phi^\circ_{\text{正}}=0.771\,\text{V}$,$\phi^\circ_{\text{负}}=0.799\,\text{V}$
$\lg K^\theta = \frac{1 \times (0.771 - 0.799)}{0.0592} \approx -0.473$
$K^\theta \approx 10^{-0.473} \approx 0.338 \approx 0.34$