第11章电解与库仑分析法[11-1] 解释下列名词。电解、理论分解电压、实际分解电压、析出电位、控制电流电解法、控制电位电解法、汞阴极电解法、死停终点法、电流效率。答:电解:将电流通过电解质溶液或熔融态电解质,(又称电解液),在阴极和阳极上引起氧化还原反应的过程,电化学电池在外加直流电压时可发生电解过程。理论分解电压:使被电解的物质在两个电极上产生迅速的、连续不断的电极反应时所需要的最小外加电压的最小外加电压。实际分解电压:指使电解质在电极上分解生成电解产物所需施加的最小电压。析出电位:物质在阴极上产生迅速的 连续不断的电极反应而被还原析出时所需要的最正的阴极电位 或在阳极上被氧化析出时的阴极电位;或在阳极上被氧化析出时所需要的最负阳极电位。控制电流电解法:在恒定的电流条件下进行电解,通过称量电解前后电极上沉积的析出物的质量来进行定量分析。控制电位电解法:控制工作电极(阴极或阳极)电位为一恒定值的条件下进行电解的分离分析方法。汞阴极电解法:电解时以汞作阴极,铂为阳极的电解法。死停终点法:指把两个相同的铂电极插入滴定溶液中,在两个电极之间外加一小电压,观察滴定过程中通过两个电极间的电流突变,根据电流的变化情况确定滴定终点。电流效率:指电解时在电极上实际沉积或溶解的物质的量与按理论计算出的析出或溶解量之比,通常用符号η表示。[11-2] 什么是电解分析和库仑分析?它们的共同点是什么?不同点是什么?答:电解分析是指在外加电压的作用下 通过电极反应将试液中的待测组分转变为固相析出,称量析出物的重量以求得被测组分的含量。库仑分析是指通过测量被测物质在100%电流效率下电解所消耗的电量来进行定量分析的方法。共同点:测定的过程中不需要基准物质和标准溶液,且都基于电解反应。不同点:电解分析采用称量电解后铂阴极的增量来定量的,电极不一定具有100%的电流效率;库仑分析用电解过程中消耗的电量来定量,要求电极反应必须单纯,用于测定的电极反应必须具有100%的电流效率,电量全部消耗在被测物质上。[11-3] 写出电解方程的数学表达式,并说明其中各项的含义。[11-4] 在电解分析中,一般使用的工作电极面积较大,而且要搅拌,这是为什么?有时还要加入惰性电解质、pH缓冲液和络合剂,这又是为什么?答:因为在电解分析中会出现极化现象所以为了减少电流密度消除极化现象而进行的消除超 电位对电极电位影响后者是为了控制阴极电位, 以为随着电解过程中的进行, 阴极电位不断 发生变化阳极电位也不完全恒定。[11-5] 库伦分析的基本原理是什么?基本要求又是什么?控制电位和控制电流的库伦分析是如何达到基本要求的?答:电解分析是采用称量电解后铂阴极电位的增量来做定量的,如果用电解过程中消耗的电 量来定量这就是库伦分析的基本要求,是电极反应必须单纯。用于测定的电极反应必须是具有100%的电流效率,电量全部消耗在被测物上,控制电位的库伦是控制工作电极电位保持 中恒定值得被测物质以100%的电流效应进行电解,控制电流的库伦分析是在恒定电流下具 有 100%的电流效率且设法指示终点到达。[11-6] 某电解池由两支铂电极组成,它的内阻为0.60Ω,铂电极的面积为100cm2。将两支铂电极插入20mL 0.5mol·L-1H2SO4和0.1mol·L-1Ag+溶液中进行电解。已知:通过电解池的电流为1.80A; =0.799V, =1.229V;电流密度为0.010A/cm2时,O2在铂电极上的超电位为0.85V。(1)写出电池的图解表达式;(2)计算电解Ag+的理论分解电压和开始沉积Ag时需要的外加电压。答:(2)0.49V;2.43V[11-7] 如果要用电解的方法从含1.00×10-2mol·L-1Ag+,2.00mol·L-1Cu2+的溶液中,使Ag+完全析出,(浓度达到10-6mol·L-1)而与Cu2+完全分离,铂阴极的电位应控制在什么数值上?(vs.SCE,不考虑超电位)
第11章电解与库仑分析法
[11-1] 解释下列名词。
电解、理论分解电压、实际分解电压、析出电位、控制电流电解法、控制电位电解法、汞阴极电解法、死停终点法、电流效率。
答:电解:将电流通过电解质溶液或熔融态电解质,(又称电解液),在阴极和阳极上引起氧化还原反应的过程,电化学电池在外加直流电压时可发生电解过程。
理论分解电压:使被电解的物质在两个电极上产生迅速的、连续不断的电极反应时所需要的最小外加电压的最小外加电压。
实际分解电压:指使电解质在电极上分解生成电解产物所需施加的最小电压。
析出电位:物质在阴极上产生迅速的 连续不断的电极反应而被还原析出时所需要的最正的阴极电位 或在阳极上被氧化析出时的阴极电位;或在阳极上被氧化析出时所需要的最负阳极电位。
控制电流电解法:在恒定的电流条件下进行电解,通过称量电解前后电极上沉积的析出物的质量来进行定量分析。
控制电位电解法:控制工作电极(阴极或阳极)电位为一恒定值的条件下进行电解的分离分析方法。
汞阴极电解法:电解时以汞作阴极,铂为阳极的电解法。
死停终点法:指把两个相同的铂电极插入滴定溶液中,在两个电极之间外加一小电压,观察滴定过程中通过两个电极间的电流突变,根据电流的变化情况确定滴定终点。
电流效率:指电解时在电极上实际沉积或溶解的物质的量与按理论计算出的析出或溶解量之比,通常用符号η表示。
[11-2] 什么是电解分析和库仑分析?它们的共同点是什么?不同点是什么?
答:电解分析是指在外加电压的作用下 通过电极反应将试液中的待测组分转变为固相析出,称量析出物的重量以求得被测组分的含量。库仑分析是指通过测量被测物质在100%电流效率下电解所消耗的电量来进行定量分析的方法。
共同点:测定的过程中不需要基准物质和标准溶液,且都基于电解反应。
不同点:电解分析采用称量电解后铂阴极的增量来定量的,电极不一定具有100%的电流效率;库仑分析用电解过程中消耗的电量来定量,要求电极反应必须单纯,用于测定的电极反应必须具有100%的电流效率,电量全部消耗在被测物质上。
[11-3] 写出电解方程的数学表达式,并说明其中各项的含义。
[11-4] 在电解分析中,一般使用的工作电极面积较大,而且要搅拌,这是为什么?有时还要加入惰性电解质、pH缓冲液和络合剂,这又是为什么?
答:因为在电解分析中会出现极化现象所以为了减少电流密度消除极化现象而进行的消除超 电位对电极电位影响后者是为了控制阴极电位, 以为随着电解过程中的进行, 阴极电位不断 发生变化阳极电位也不完全恒定。
[11-5] 库伦分析的基本原理是什么?基本要求又是什么?控制电位和控制电流的库伦分析是如何达到基本要求的?
答:电解分析是采用称量电解后铂阴极电位的增量来做定量的,如果用电解过程中消耗的电 量来定量这就是库伦分析的基本要求,是电极反应必须单纯。用于测定的电极反应必须是具有100%的电流效率,电量全部消耗在被测物上,控制电位的库伦是控制工作电极电位保持 中恒定值得被测物质以100%的电流效应进行电解,控制电流的库伦分析是在恒定电流下具 有 100%的电流效率且设法指示终点到达。
[11-6] 某电解池由两支铂电极组成,它的内阻为0.60Ω,铂电极的面积为100cm2。将两支铂电极插入20mL 0.5mol·L-1H2SO4和0.1mol·L-1Ag+溶液中进行电解。已知:通过电解池的电流为1.80A; =0.799V, =1.229V;电流密度为0.010A/cm2时,O2在铂电极上的超电位为0.85V。
(1)写出电池的图解表达式;
(2)计算电解Ag+的理论分解电压和开始沉积Ag时需要的外加电压。
答:(2)0.49V;2.43V
[11-7] 如果要用电解的方法从含1.00×10-2mol·L-1Ag+,2.00mol·L-1Cu2+的溶液中,使Ag+完全析出,(浓度达到10-6mol·L-1)而与Cu2+完全分离,铂阴极的电位应控制在什么数值上?(vs.SCE,不考虑超电位)
题目解答
答案
解:①先算Cu的起始析出电位:
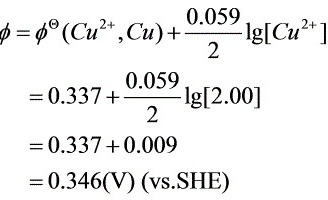
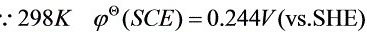
∴Cu开始析出的电位为: 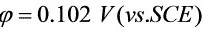
②Ag的起始析出电位:
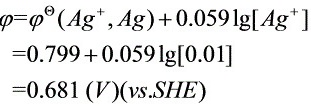
Ag开始析出的电位为: 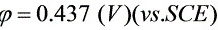
当Ag+的浓度从1.00×10-2 mol L-1降至10-6 mol L-1时,一般认为Ag+已电解完全,此时 Ag的电极电位为:
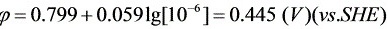
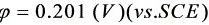 >Cu开始析出的电位为:
>Cu开始析出的电位为: 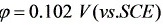 。
。
所以,当阴极电压控制在0.102-0.201V之间,电解结束时,Ag+可以完全还原析出而Cu2+仍留在溶液中,达到完全分离。
[11-8] 将含有Cd和Zn的矿样1.06g完全溶解后,在氨性溶液中用汞阴极沉积。当阴极电位维持在-0.95V(vs.SCE)时,只有Cd沉积,在该电位下电流趋近于零时,与电解池串联的氢氧库仑计收集到混合气体的体积为44.61mL(25℃,101325 Pa)。在-1.3V时,Zn2+还原,与上述条件相同,当Zn电解完全时,收集到的混合气体为31.30mL。求该矿中Cd和Zn的质量分数。
解:依据m=VM/(0.1741×96485n)
所以Cd%=mCd/1.06=44.61×112/(0.1741×96485×2×1.06)=14.03%
Zn%=mZn/1.06=31.30×65/(0.1741×96485×2×1.06)=5.71%
[11-9] 将9.14mg纯苦味酸(M苦味酸=228.93g·mol-1)试样以1 mol L-1HCl完全溶解后,全部移入汞阴极池中,用恒电位库伦法[-0.65V(vs.SCE)]进行电解。当电解完全,与电解池相串联的库仑计求得的电荷量为65.7C,求此还原反应的电子转移数n?
解:根据m=MQ/nF可得:
n=MQ/mF=228.93×65.7/(9.14×10-3×96485)=17
[11-10] 用库仑法测定某炼焦厂下游河水中酚的含量。取100mL水样,酸化后加入过量KBr,电解产生的Br2与酚发生如下反应: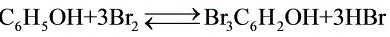 ,通过恒定的电流为15.0mA,经8min20s到达终点。计算水中酚的含量(以mg/L表示)。已知:
,通过恒定的电流为15.0mA,经8min20s到达终点。计算水中酚的含量(以mg/L表示)。已知: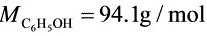 。
。
解: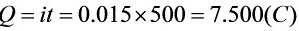
由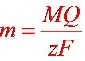 ,M=94,z=6,故
,M=94,z=6,故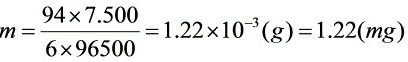
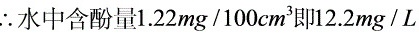
[11-11] 库仑滴定法测定某有机酸的m(1mol)/z值。溶解0.0231g纯净试样于乙醇-水混合溶剂中,以电解产生的OH-离子滴定此溶液,用酚酞作指示剂进行滴定。当达终点时,电解时间为402s,电解电流为0.0427A。计算此有机酸的m(1mol)/z值。
解: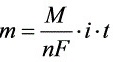 (其中t=402s)
(其中t=402s)
代入数据: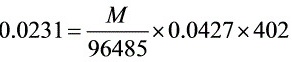
解得:M=129.8g·mol-1