题目
已知硝基苯C6H5NO2(l),在正常沸点483K时的摩尔蒸发焓为40.75 kJ·mol-1,试求:(1) 1mol硝基苯在483K,101.325kPa定温定压下完全汽化过程的Q、W、ΔH、ΔS和ΔG。(2) 1mol硝基苯在483K,130kPa定温定压下完全汽化过程的ΔG,并判断该过程能否自发进行。
已知硝基苯C6H5NO2(l),在正常沸点483K时的摩尔蒸发焓为40.75 kJ·mol-1,试求:
(1) 1mol硝基苯在483K,101.325kPa定温定压下完全汽化过程的Q、W、ΔH、ΔS和ΔG。
(2) 1mol硝基苯在483K,130kPa定温定压下完全汽化过程的ΔG,并判断该过程能否自发进行。
题目解答
答案
(1) 483K,101.325kPa定温定压下硝基苯汽化过程为可逆相变过程,ΔG = 0。
可逆相变过程吸热 Q = ΔH= n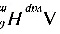 = 40.75 kJ
= 40.75 kJ
汽化过程做功 W= -pΔV=-ΔnRT= -4015.9 J
ΔU= Q + W= 36734.1 J
ΔS=ΔH/T= 84.37 J·K-1
(2) 设计可逆过程如下图所示
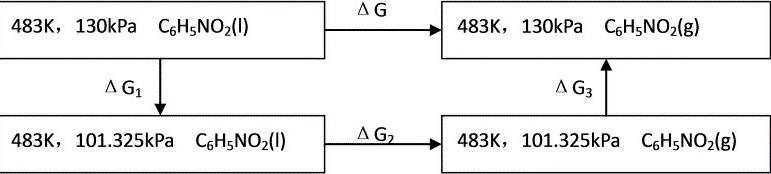
483K,130kPa定温定压下硝基苯汽化过程的ΔG=ΔG1+ΔG2+ΔG3=ΔG1+ΔG3
因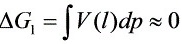 ,
,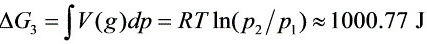
故ΔG=ΔG1+ΔG3 = 1000.77 J >0,该过程不能自发进行。
解析
步骤 1:计算483K,101.325kPa定温定压下硝基苯汽化过程的Q、W、ΔH、ΔS和ΔG
在483K,101.325kPa定温定压下,硝基苯的汽化过程为可逆相变过程,因此ΔG = 0。根据热力学第一定律,Q = ΔH = 40.75 kJ。汽化过程做功W = -pΔV = -ΔnRT = -4015.9 J。根据热力学第一定律,ΔU = Q + W = 36734.1 J。根据热力学第二定律,ΔS = ΔH/T = 84.37 J·K-1。
步骤 2:计算483K,130kPa定温定压下硝基苯汽化过程的ΔG
设计可逆过程如下图所示:
483K,130kPa C6H5 NO2(l) $\Delta G$ 483K,130kPa C6H5 NO2(g) △G1 $\Delta {G}_{3}$ 483K,101.325kPa C6H NO2(l) △G2 483K,101.325kPa C6H5NO2(g)
483K,130kPa定温定压下硝基苯汽化过程的ΔG=ΔG1+ΔG2+ΔG3=ΔG1+ΔG3。因$0\approx dp(1)A] =bv$,$\Delta {G}_{3}=\int v(g)dp=RT\ln ({p}_{2}/{p}_{1})\approx 1000.77.$。故ΔG=ΔG1+ΔG3 = 1000.77 J >0,该过程不能自发进行。
在483K,101.325kPa定温定压下,硝基苯的汽化过程为可逆相变过程,因此ΔG = 0。根据热力学第一定律,Q = ΔH = 40.75 kJ。汽化过程做功W = -pΔV = -ΔnRT = -4015.9 J。根据热力学第一定律,ΔU = Q + W = 36734.1 J。根据热力学第二定律,ΔS = ΔH/T = 84.37 J·K-1。
步骤 2:计算483K,130kPa定温定压下硝基苯汽化过程的ΔG
设计可逆过程如下图所示:
483K,130kPa C6H5 NO2(l) $\Delta G$ 483K,130kPa C6H5 NO2(g) △G1 $\Delta {G}_{3}$ 483K,101.325kPa C6H NO2(l) △G2 483K,101.325kPa C6H5NO2(g)
483K,130kPa定温定压下硝基苯汽化过程的ΔG=ΔG1+ΔG2+ΔG3=ΔG1+ΔG3。因$0\approx dp(1)A] =bv$,$\Delta {G}_{3}=\int v(g)dp=RT\ln ({p}_{2}/{p}_{1})\approx 1000.77.$。故ΔG=ΔG1+ΔG3 = 1000.77 J >0,该过程不能自发进行。