利用催化氧化反应将SO_(2)转化为SO_(3)是工业上生产硫酸的关键步骤。已知:SO_(2) left(gright)+frac(1)(2)O_(2)(g)═SO_(3)(g)triangle H=-98kJ/mol。(1)某温度下该反应的平衡常数K=frac(10)(3),若在此温度下,向100L的恒容密闭容器中,充入4.0mol SO_(2) left(gright)、9.0mol O_(2)(g)和4.0mol SO_(3)(g),则反应开始时v(正) ______ v(逆)(填“ lt ”、“ gt ”或“=”)。(2)一定温度下,向一带活塞的体积为2L的密闭容器中充入2.0mol SO_(2)和1.0molO_(2),达到平衡后体积变为1.6L,则SO_(2)的平衡转化率为______。(3)在(2)中的反应达到平衡后,改变下列条件,能使SO_(2) left(gright)平衡浓度比原来减小的是______(填字母)。A.保持温度和容器体积不变,充入1.0mol O_(2) B.降低温度C.保持温度和容器内压强不变,充入1.0molSO_(3) D.移动活塞压缩气体(4)用图装置可以进行测定SO_(2)转化成SO_(3)的转化率的实验。已知SO_(3)的熔点是16.8^circmathrm(C),沸点是445.8^circmathrm(C).已知发生装置中所涉及反应的化学方程式为Na_(2)SO_(3)(s)+H_(2)SO_(4)(98%)frac(underline{;;△;;)}(;)Na_(2)SO_(4)+H_(2)O+SO_(2)uparrow 。甲 浓硫酸-|||-O2 square 30 " m-|||-V2O5(催化剂)-|||-Na2SO3①根据实验需要,应该在I、II、Ⅲ处连接合适的装置。请从图A--E装置中选择最适合装置并将其序号填入下面的字格中。I、II、Ⅲ处连接的装置分别是______、______、______。甲 浓硫酸-|||-O2 square 30 " m-|||-V2O5(催化剂)-|||-Na2SO3②从乙处均匀通入O_(2),为使SO_(2)有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是______。③通过测量装置______的增重来计算SO_(2)的转化率。④将SO_(2)通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5times 6.02times 10^23个电子转移时,该反应的化学方程式为______。.
已知:$SO_{2} left(gright)+frac{1}{2}O_{2}(g)$═$SO_{3}(g)triangle H=-98kJ/mol$。
$(1)$某温度下该反应的平衡常数$K=frac{10}{3}$,若在此温度下,向$100L$的恒容密闭容器中,充入$4.0mol SO_{2} left(gright)$、$9.0mol O_{2}(g)$和$4.0mol SO_{3}(g)$,则反应开始时$v($正$) ______ v($逆$)($填“$ lt $”、“$ gt $”或“$=$”)。
$(2)$一定温度下,向一带活塞的体积为$2L$的密闭容器中充入$2.0mol SO_{2}$和$1.0molO_{2}$,达到平衡后体积变为$1.6L$,则$SO_{2}$的平衡转化率为______。
$(3)$在(2)中的反应达到平衡后,改变下列条件,能使$SO_{2} left(gright)$平衡浓度比原来减小的是______$(填字母)$。
$A$.保持温度和容器体积不变,充入$1.0mol O_{2} B$.降低温度
$C$.保持温度和容器内压强不变,充入$1.0molSO_{3} D$.移动活塞压缩气体
$(4)$用图装置可以进行测定$SO_{2}$转化成$SO_{3}$的转化率的实验。已知$SO_{3}$的熔点是$16.8^{circ}mathrm{C}$,沸点是$445.8^{circ}mathrm{C}$.已知发生装置中所涉及反应的化学方程式为
$Na_{2}SO_{3}(s)+H_{2}SO_{4}(98%)frac{underline{;;△;;}}{;}Na_{2}SO_{4}+H_{2}O+SO_{2}uparrow $。
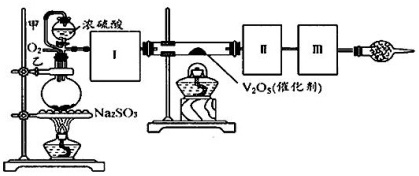
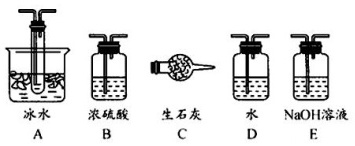
①根据实验需要,应该在$I$、$II$、Ⅲ处连接合适的装置。请从图$A--E$装置中选择最适合装置并将其序号填入下面的字格中。$I$、$II$、Ⅲ处连接的装置分别是______、______、______。
②从乙处均匀通入$O_{2}$,为使$SO_{2}$有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是______。
③通过测量装置______的增重来计算$SO_{2}$的转化率。
④将$SO_{2}$通入含$1.5mol$氯酸的溶液中,可生成一种强酸和一种氧化物,若有$1.5times 6.02times 10^{23}$个电子转移时,该反应的化学方程式为______。.
题目解答
答案
(1)向$100L$的恒容密闭容器中,充入$4.0mol SO_{2} left(gright)$、$9.0mol O_{2}(g)$和$4.0mol SO_{3}(g)$,浓度商$Qc=frac{0.04mol/L}{0.04mol/L×(0.09mol/L)^{frac{1}{2}}}=frac{10}{3}=K$,此时反应平衡,故正反应速率等于逆反应速率;
故答案为:$=$;
$(2)$根据$V_{前}/V_{后}=n_{前}/n_{后}$可得,向一带活塞的体积为$2L$的密闭容器中充入$2.0mol SO_{2}$和$1.0mol O_{2}$,达到平衡后体积变为$1.6L$,$n_{后}=2.4mol$
$ SO_{2}(g)+frac{1}{2}O_{2}(g)rightleftharpoons SO_{3}(g)$
开始$left(molright) 2.0 1.0 0$
反应$left(molright) a frac{1}{2}a a$
平衡$left(molright) 2.0-a 1-frac{1}{2}a a$
则:$left(2.0-aright)+(1.0-frac{1}{2}a)+a=2.4$
$a=1.2$
所以$SO_{2}$的转化率$alpha =frac{1.2mol}{2mol}times 100%=60%$;
故答案为:$60%$;
$(3)A$、保持温度和容器体积不变,$O_{2}$的浓度增大,平衡正向移动,$SO_{2}$的浓度减小,故$A$正确;
$B$、降低温度,平衡向放热的方向移动,而正反应为放热,所以平衡正向移动,$SO_{2}$的浓度减小,故$B$正确;
$C$、保持温度和容器内压强不变,充入$1.0mol SO_{3}$,新的平衡与原平衡等效,$SO_{2}$的浓度不变,故$C$错误;
$D$、移动活塞压缩气体,$SO_{2}$的浓度瞬间增大,之后平衡向气体体积减少的方向移动,即向正反应方向移动,$SO_{2}$的浓度减小,再次到达平衡时$SO_{2}$的浓度仍比原来大,所以$D$错误;
故答案为:$AB$;
$(4)$①$Ⅰ$装置必须要对二氧化硫进行干燥,可以用浓硫酸来干燥二氧化硫气体;$SO_{3}$的熔点是$16$,$8^{circ}mathrm{C}$,可以用冰水来获得三氧化硫;未反应掉的二氧化硫对空气会产生污染,可以用碱石灰或者氢氧化钠溶液来进行尾气处理;
故答案为:$B$、$A$、$E/C$;
②从乙处均匀通入$O_{2}$,为使$SO_{2}$有较高的转化率,使产生的二氧化硫尽可能多的转化为三氧化硫,应先加热催化剂再滴入浓硫酸;
故答案为:先加热催化剂,再滴入浓硫酸;
③根据上述分析可知,装置$II$和$III$分别收集的是$SO3$和$SO_{2}$,因此应通过测量装置$II$和$III$的增重来计算$SO_{2}$的转化率;
故答案为:$II$和$III$或$A$和$E/C$;
④氯酸具有氧化性,其中氯元素的化合价为$+5$价,有$1.5times 6.02times 1023$个即$1.5mol$电子转移时,$1.5mol$氯酸中氯元素的化合价应由$+5$价降到$+4$价,所以产物中氯元素以二氧化氯的形式存在,二氧化硫被氧化为硫酸,故反应为:$SO_{2}+2HClO_{3}=H_{2}SO_{4}+2ClO_{2}$;
故答案为:$SO_{2}+2HClO_{3}=H_{2}SO_{4}+2ClO_{2}$。